题目内容
2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中.
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol?L-1的浓硫酸配制250mL 4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 .
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点).
(3)加入H2O2的作用是 .调节溶液的pH=8是为了除去 离子.
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是 .
(5)还原过程发生以下反应(请配平):
Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4;
Ⅱ:(1)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为 .在阴极附近溶液pH升高的原因是(用电极反应方程式解释) .
(2)含铬废水国家排放标准为
含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,
用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准 .
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)酸浸时,为了提高浸取率可采取的措施是
(3)加入H2O2的作用是
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(5)还原过程发生以下反应(请配平):
Ⅱ:(1)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为
(2)含铬废水国家排放标准为
| +6 |
| Cr |
用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题
分析:Ⅰ.(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;(2)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(4)钠离子交换树脂交换的离子是钙离子和镁离子;
(5)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写;
Ⅱ.(1)用Fe为电极进行电解生成Fe2+,溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高;
(2)根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O计算.
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(4)钠离子交换树脂交换的离子是钙离子和镁离子;
(5)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写;
Ⅱ.(1)用Fe为电极进行电解生成Fe2+,溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高;
(2)根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O计算.
解答:
解:Ⅰ.(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为Cr2O72-,以便于与杂质离子分离,硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液pH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离;Fe3+、Al3+;
(4)钠离子交换树脂交换的离子是钙离子和镁离子,因为在此之前,Fe3+被除去,Al3+转化为偏铝酸根的形式,故答案为:Ca2+、Mg2+;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2Cr2O7氧化为硫酸,Na2Cr2O7氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;Na2Cr2O7+3SO2+11H2O═2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1、3、11H2O、2、1;
Ⅱ.(1)用Fe为电极进行电解,铁作阳极,阳极反应为Fe-2e-═Fe2+,在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑,
故答案为:Fe-2e-═Fe2+;2H++2e-=H2↑;
(2)废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL,
Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
1 6
n(Cr2O72-) 9×10-3L×0.0001mol/L
n(Cr2O72-)=1.5×10-7mol,废水1L中n(Cr2O72-)=7.5×10-7mol,废水1L中n(
)=1.5×10-6mol,电解后的废水中
含量=1.5×10-6mol×52g/mol=0.0780 mg/L,符合国家排放标准为
含量≤0.1000mg/L.
故答案为:经计算知,上述电解后的废水中
含量=0.0780 mg/L,符合国家排放标准.
(2)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为Cr2O72-,以便于与杂质离子分离,硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液pH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离;Fe3+、Al3+;
(4)钠离子交换树脂交换的离子是钙离子和镁离子,因为在此之前,Fe3+被除去,Al3+转化为偏铝酸根的形式,故答案为:Ca2+、Mg2+;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2Cr2O7氧化为硫酸,Na2Cr2O7氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;Na2Cr2O7+3SO2+11H2O═2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1、3、11H2O、2、1;
Ⅱ.(1)用Fe为电极进行电解,铁作阳极,阳极反应为Fe-2e-═Fe2+,在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑,
故答案为:Fe-2e-═Fe2+;2H++2e-=H2↑;
(2)废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL,
Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
1 6
n(Cr2O72-) 9×10-3L×0.0001mol/L
n(Cr2O72-)=1.5×10-7mol,废水1L中n(Cr2O72-)=7.5×10-7mol,废水1L中n(
| +6 |
| Cr |
| +6 |
| Cr |
| +6 |
| Cr |
故答案为:经计算知,上述电解后的废水中
| +6 |
| Cr |
点评:本题考查了溶液配制、化学方程式的配平、电解原理等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
向27.2g Cu和Cu2O(物质的量之比为2:1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是( )
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
下列实验操作正确的是( )
| A、用丁达尔现象区分淀粉溶胶和豆浆 |
| B、钠和水反应实验时,余下的金属钠放回原瓶 |
| C、浓硫酸与浓硝酸混合时,将浓硝酸加入浓硫酸中 |
| D、蒸发结晶时,把液体蒸干再停止加热 |
下列气体中不能用排水法收集的是( )
| A、氢气 | B、氨气 | C、氧气 | D、氮气 |
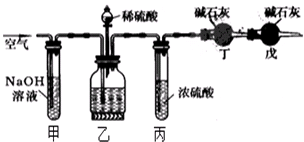 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:

 也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式
也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式