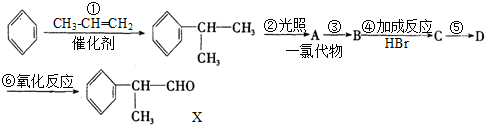
题目内容
下列实验操作正确的是( )
| A、用丁达尔现象区分淀粉溶胶和豆浆 |
| B、钠和水反应实验时,余下的金属钠放回原瓶 |
| C、浓硫酸与浓硝酸混合时,将浓硝酸加入浓硫酸中 |
| D、蒸发结晶时,把液体蒸干再停止加热 |
考点:胶体的重要性质,浓硫酸的性质,钠的化学性质,蒸发和结晶、重结晶
专题:
分析:A.淀粉溶胶和豆浆都是胶体;
B.金属钠能与空气中的水或氧气反应;
C.浓硫酸稀释放热,配制时应将浓硫酸倒入其他溶液;
D.蒸发结晶时当有大量固体析出时,就要停止加热.
B.金属钠能与空气中的水或氧气反应;
C.浓硫酸稀释放热,配制时应将浓硫酸倒入其他溶液;
D.蒸发结晶时当有大量固体析出时,就要停止加热.
解答:
解:A.淀粉溶胶和豆浆都是胶体,都有丁达尔效应,故A错误;
B.金属钠能与空气中的水或氧气反应,剩余的药品要放回原瓶不存在安全隐患,故B正确;
C.配制硫酸溶液时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌,故C错误;
D.在蒸发操作的过程中,加热时要 用玻璃棒不断搅拌,以防液体飞溅,当加热到有少量液体剩余时停止加热,此时剩下的少量液体可以利用余温蒸发干,故D错误.
故选B.
B.金属钠能与空气中的水或氧气反应,剩余的药品要放回原瓶不存在安全隐患,故B正确;
C.配制硫酸溶液时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌,故C错误;
D.在蒸发操作的过程中,加热时要 用玻璃棒不断搅拌,以防液体飞溅,当加热到有少量液体剩余时停止加热,此时剩下的少量液体可以利用余温蒸发干,故D错误.
故选B.
点评:本题考查胶体、实验安全、溶液配制等,难度不大,注意金属钠能放回原瓶.

练习册系列答案
相关题目
己烯雌酚是一种激素类药物,结构如 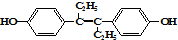 下列叙述中正确的是( )
下列叙述中正确的是( )
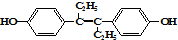 下列叙述中正确的是( )
下列叙述中正确的是( )| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、该分子中有2个H,2个O,6个C共直线 |
某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是( )
| A、加入的酸过量 |
| B、生成的盐不水解 |
| C、酸和碱等物质的量混合 |
| D、反应后溶液中c(A-)=c(M+) |
已知①当溶液中某种离子浓度小于10-5mol/L时即可看作完全沉淀; ②常温下Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=1.25×10-36; ③lg2=0.3.
现有浓度均为0.022mol/L的CuSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
现有浓度均为0.022mol/L的CuSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
| A、当调节溶液的pH至3.7时,Fe3+才能完全沉淀 |
| B、当c(OH-)达到10-9时,Cu2+开始沉淀,此时Fe3+尚未沉淀完全 |
| C、原溶液中,c(SO42-):[c(Cu2+)+c(Fe3+)]=4:3 |
| D、若要除去上述混合溶液中的Fe3+,加入NaOH固体比加入Cu(OH)2效果好 |
下列说法中,正确的是( )
| A、强电解质溶液一定比弱电解质溶液导电能力强 |
| B、不溶性盐是弱电解质 |
| C、强电解质的水溶液中不存在溶质分子 |
| D、因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多 |
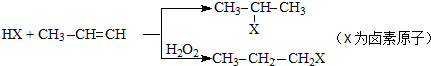
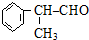 ,该物质是一种香料.
,该物质是一种香料.