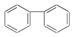
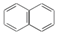
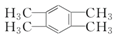
题目内容
3.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )| A. | 检验自来水中是否含Cl- | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 鉴别AgNO3 溶液和BaCl2 溶液 | D. | 除去热水瓶内壁上的水垢 |
分析 A、氯离子检验需要用到硝酸银和稀硝酸;
B、鸡蛋壳主要成分是碳酸钙,碳酸钙溶于醋酸;
C、氯化钡溶液和硝酸银溶液中加入食盐生成沉淀的是硝酸银;
D、水垢主要成分是氢氧化镁和碳酸钙,食醋可以溶解水垢.
解答 解:A、氯离子检验需要用到硝酸银和稀硝酸,不是家庭厨房中常用的物质,故A错误;
B、鸡蛋壳主要成分是碳酸钙,碳酸钙溶于醋酸,可以利用碳酸钙溶解生成二氧化碳气体检验,故B正确;
C、氯化钡溶液和硝酸银溶液中,加入食盐溶于,生成沉淀的是硝酸银,没有变化的是氯化钡,故C正确;
D、水垢主要成分是氢氧化镁和碳酸钙,食醋可以溶解水垢,可以除去热水瓶中的水垢,故D正确;
故选A.
点评 本题考查了常见离子检验的分析判断,物质性质的应用是解题关键,题目较简单.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
13.高温下,某反应平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$?_{高温高压}^{催化剂}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 升高温度,平衡右移,逆反应速率减小 |
14.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中,正确的是( )
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
11.下列有关说法正确的是( )
| A. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为C2H4和C4H8的物质一定互为同系物 | |
| D. | 键线式为  的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
8.随着科技的不断进步,15N、N70、N5+、NH5等已被发现.下列有关说法中,正确的是( )
| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
2.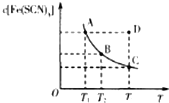 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |