题目内容
15.将14g Na2O和Na2O2的混合物加入足量的水中充分反应,生成标况下的气体1.12L,所得溶液的体积为 400mL.试计算:(1)原混合物中Na2O的质量.
(2)所得溶液的物质的量浓度.
分析 (1)n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据反应方程式2Na2O2+2H2O=4Na++4OH-+O2↑计算出过氧化钠的物质的量,从而可计算出混合物中过氧化钠、氧化钠的质量;
(2)混合物溶于水后都生成NaOH,溶液中的溶质是NaOH,根据Na原子守恒计算n(NaOH),再根据c=$\frac{n}{V}$计算c(NaOH).
解答 解:(1)n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据反应2Na2O2+2H2O=4Na++4OH-+O2↑可知,混合物中过氧化钠的物质的量为:n(Na2O2)=2n(O2)=0.05mol×2=0.1mol,
则混合物中过氧化钠的质量为:m(Na2O2)=78g/mol×0.1mol=7.8g,
氧化钠的质量为:14g-7.8g=6.2g,
答:混合物中Na2O的质量是6.2g;
(2)n(Na2O)=$\frac{6.2g}{62g/mol}$=0.1mol,n(Na2O2)=0.1mol,混合物溶于水后都生成NaOH,溶液中的溶质是NaOH,根据Na原子守恒得n(NaOH)=2n(Na2O)+2n(Na2O2)=2×(0.1+0.1)mol=0.4mol,
c=$\frac{n}{V}$=$\frac{0.4mol}{0.4L}$=1mol/L,答:所得溶液的物质的量浓度是1mol/L.
点评 本题考查混合物的计算,为高频考点,明确发生的反应及各个物理量之间的关系是解本题关键,侧重考查学生分析计算能力,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
6.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 2gH2含有的氢原子数目为NA | |
| B. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| C. | 1molZn完全变为Zn2+失去的电子数目为NA | |
| D. | 常温常压下,22.4LO2含有的分子数目为NA |
3.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
| A. | 检验自来水中是否含Cl- | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 鉴别AgNO3 溶液和BaCl2 溶液 | D. | 除去热水瓶内壁上的水垢 |
20.下列物质属于天然纤维的是( )
| A. | 粘胶纤维 | B. | 涤纶 | C. | 丙纶 | D. | 木材 |
7.对于反应4A(s)+2B(g)?3C(g),下列说法正确的是( )
| A. | 体积不变充入惰性气体,反应速率增大 | |
| B. | 其他条件不变,降低温度,平衡转化率一定变化 | |
| C. | 其他条件不变时,增大压强,平衡左移,平衡常数K减小 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
13.下列说法不正确的是( )
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
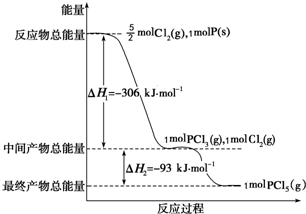 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).