题目内容
 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在.二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4).服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收.
(1)人体中经常进行Fe2+
| A |
| B |
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子.”这句话指出,维生素C在这一反应中做
(3)向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体,则其离子方程式为:
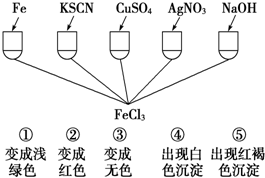
(4)为了验证Fe3+的性质,某化学兴趣小组设计了如下图所示的一组实验,其中实验结果一定错误的是
A.④和⑤B.只有③C.③和④D.①②③
(5)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向0.2mol?L-1 1L FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是
考点:探究铁离子和亚铁离子的转化,离子方程式的书写,氧化还原反应
专题:
分析:(1)含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂;
(2)根据铁元素的化合价变化可知三价铁离子被还原来分析维生素C的作用,并利用还原剂具有还原性来解答;
(3)加热时FeCl3水解生成Fe(OH)3胶体;
(4)①铁与铁离子反应生成浅绿色的亚铁离子;
②硫氰化钾与铁离子反应溶液显示红色;
③硫酸铜溶液与氯化铁不反应;
④硝酸银与氯化铁反应生成氯化银沉淀;
⑤氢氧化钠与铁离子反应生成红褐色的氢氧化铁;
(5)氯气可以氧化亚铁离子和溴离子,先氧化还原性较强的离子.
(2)根据铁元素的化合价变化可知三价铁离子被还原来分析维生素C的作用,并利用还原剂具有还原性来解答;
(3)加热时FeCl3水解生成Fe(OH)3胶体;
(4)①铁与铁离子反应生成浅绿色的亚铁离子;
②硫氰化钾与铁离子反应溶液显示红色;
③硫酸铜溶液与氯化铁不反应;
④硝酸银与氯化铁反应生成氯化银沉淀;
⑤氢氧化钠与铁离子反应生成红褐色的氢氧化铁;
(5)氯气可以氧化亚铁离子和溴离子,先氧化还原性较强的离子.
解答:
解:(1)在A中铁元素的化合价由+2价升高到+3价,铁元素的化合价升高,则A中Fe2+做还原剂,在B中铁元素的化合价由+3价降低为+2价,铁元素的化合价降低,则B中Fe3+做氧化剂,故答案为:还原;氧化;
(2)由信息维生素C可使食物中的三价铁离子还原成二价铁离子,该反应中铁元素的化合价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性,故答案为:还原;还原.
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,反应的化学方程式为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,其水解方程式为Fe3++3H2O
Fe(OH)3(胶体)+3H+;
故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;
(4)①铁离子与铁反应生成浅绿色的亚铁离子,故①正确;
②铁离子与硫氰化钾溶液反应显示红色,据此能够检验铁离子,故②正确;
③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,故③错误;
④氯化铁与硝酸银反应生成白色氯化银沉淀,但没有体现铁离子的性质,故④错误;
⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,故⑤正确;
故选B.
(5)还原性Fe2+>Br-,向0.2mol/L1L FeBr2溶液中通入标准状况下氯气2.24L(即0.1mol)时,氯气先将亚铁离子氧化,如果氯气剩余再氧化溴离子,而0.1mol氯气只能和0.2mol的亚铁离子恰好反应,所以被氧化的微粒是只有亚铁离子,即2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe2+,2Fe2++Cl2=2Fe3++2Cl-.
(2)由信息维生素C可使食物中的三价铁离子还原成二价铁离子,该反应中铁元素的化合价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性,故答案为:还原;还原.
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,反应的化学方程式为:Fe3++3H2O
| ||
| ||
故答案为:Fe3++3H2O
| ||
(4)①铁离子与铁反应生成浅绿色的亚铁离子,故①正确;
②铁离子与硫氰化钾溶液反应显示红色,据此能够检验铁离子,故②正确;
③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,故③错误;
④氯化铁与硝酸银反应生成白色氯化银沉淀,但没有体现铁离子的性质,故④错误;
⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,故⑤正确;
故选B.
(5)还原性Fe2+>Br-,向0.2mol/L1L FeBr2溶液中通入标准状况下氯气2.24L(即0.1mol)时,氯气先将亚铁离子氧化,如果氯气剩余再氧化溴离子,而0.1mol氯气只能和0.2mol的亚铁离子恰好反应,所以被氧化的微粒是只有亚铁离子,即2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe2+,2Fe2++Cl2=2Fe3++2Cl-.
点评:本题属于信息习题,考查氧化还原反应中氧化剂、还原剂及氧化性、还原性,明确元素的化合价变化来分析是解答本题的关键,难度不大.

练习册系列答案
相关题目
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)△H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol?L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| B、T1温度下的平衡常数K1=125(mol?L-1)3,平衡时N2O5的转化率为50% | ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
麦考酚酸是一种有效的免疫抑制剂,其结构简式如图所示.下列有关麦考酚酸说法正确的是( )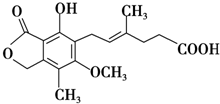

| A、分子式为C17H22O6 |
| B、能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2 |
| C、1 mol麦考酚酸最多能与3 mol NaOH反应 |
| D、在一定条件下可发生加成、加聚、取代、消去反应 |
下列各组溶液,不用其他试剂,就可将它们区别开的是( )
| A、盐酸 氢氧化钠 碳酸钠 硫酸铜 |
| B、盐酸 硝酸银 氯化钠 硝酸钠 |
| C、氢氧化钠 硫酸镁 氯化钠 盐酸 |
| D、氯化钡 硫酸钠 氯化钙 硝酸钙 |
下列说法正确的是( )
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、将含硫酸的废液倒入水槽,用水冲入下水道 |
下列物质,既能和稀H2SO4溶液反应又能和NaOH溶液反应的是( )
①
②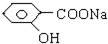
③AL(OH)3
④NaHCO3
⑤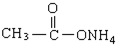
①

②

③AL(OH)3
④NaHCO3
⑤
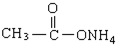
| A、全部 | B、仅①②③④ |
| C、仅①④⑤ | D、仅①②③ |

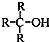 )不能氧化成醛或酮.
)不能氧化成醛或酮.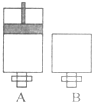 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.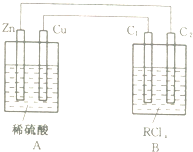 某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.
某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.