题目内容
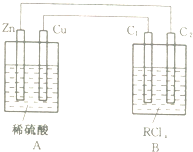 某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.
某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.考点:电解原理
专题:
分析:A为原电池,B为电解池,铜电极为原电池正极,氢离子在铜电极上得到电子生成氢气;B烧杯中C2极为电解池的阴极,Rx+在C2极发生还原反应生成R,依据串联电路特点,可知铜电极、C2极转移的电子数相同,据此计算R的相对原子质量.
解答:
解:金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L,可知RClx的摩尔质量=
=135g/mol,
由题意可知:A为原电池,B为电解池,铜电极为原电池正极,氢离子在铜电极上得到电子生成氢气,电极反应式为:2H++2e-=H2↑;B烧杯中C2极为电解池的阴极,Rx+在C2极发生还原反应生成R,电极反应式为:Rx++xe-=R,Cu极上放出11.2mL的气体,物质的量为0.0005mol,电子转移0.001mol,依据串联电路特点,可知铜电极、C2极转移的电子数相同,C2极也应转移0.001mol电子,依据Rx++xe-=R,如果R为+1价,也就是x=1,那么C2增重0.032g为0.001mol,R的相对原子质量为32,这与RClx的摩尔质量是135g/mol不符,如果R为+2价,也就是x=2,那么C2增重0.032g为0.0005mol,R的相对原子质量为64,正好RClx的摩尔质量是135g/mol,所以R的相对原子质量为64,
答:金属R的相对原子质量为64.
| 13.5g |
| 0.1mol |
由题意可知:A为原电池,B为电解池,铜电极为原电池正极,氢离子在铜电极上得到电子生成氢气,电极反应式为:2H++2e-=H2↑;B烧杯中C2极为电解池的阴极,Rx+在C2极发生还原反应生成R,电极反应式为:Rx++xe-=R,Cu极上放出11.2mL的气体,物质的量为0.0005mol,电子转移0.001mol,依据串联电路特点,可知铜电极、C2极转移的电子数相同,C2极也应转移0.001mol电子,依据Rx++xe-=R,如果R为+1价,也就是x=1,那么C2增重0.032g为0.001mol,R的相对原子质量为32,这与RClx的摩尔质量是135g/mol不符,如果R为+2价,也就是x=2,那么C2增重0.032g为0.0005mol,R的相对原子质量为64,正好RClx的摩尔质量是135g/mol,所以R的相对原子质量为64,
答:金属R的相对原子质量为64.
点评:本题考查了相对原子质量的计算,明确电解池、原电池工作原理是解题关键,注意电化学计算中转移电子数守恒规律的运用,题目难度中等.

练习册系列答案
相关题目
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶 液; ③加入稍过量的BaCl2溶液;④滴入适量的稀盐酸;⑤过滤.正确的操作顺序是( )
| A、②③①⑤④ |
| B、①②③⑤④ |
| C、②③①④⑤ |
| D、③⑤②①④ |
下列有关电解精炼铜的说法中错误的是( )
| A、粗铜做正极 |
| B、电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子 |
| C、阳极泥中含有金、银等贵重金属 |
| D、电解质溶液可以选用硫酸铜溶液 |
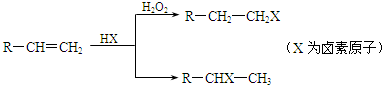
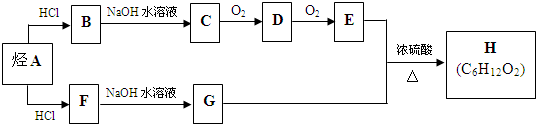
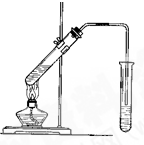 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.