题目内容
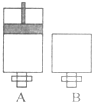 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.(1)在 A、B 中分别充入 lmolO2、2molSO2,使V (A )=V ( B ),在相同温度下反应,则:
①达平衡所需时间:t(A )
②若 A 容器中反应达到平衡后c(SO2 )是 a mol.L-1,在恒温下缓慢加压使容器的容积减小到平衡时的一半,则再次达到平衡时 c ( SO2 )的取值范围是
( 2 )若容器起始容积为 1 00L,向 A 中充入0.8molO2和1.6molSO2,平衡时测得混合气体的密度为1.6g.L-1则:①平衡时 A 的体积为
②若起始时充入 a molO2、bmolSO2,且 a:b=1:2,在相同的温度和压强下达到平衡时,测知V (A )=120L,则 a、b 的值分别为
( 3)在 B 中加入 6.5molO2、x moISO2、2.0molSO3 后,若要求通过调节体系温度使之达到平衡时,容器内气体总物质的量为 12mol.
①若 x=5.5时,需降低温度才能使反应达到平衡时气体总物质的量为 12mol.则该反应的正反应是
②若维持起始反应向逆反应方向移动,则 x 的取值范围是
考点:化学平衡的计算,有关范围讨论题的计算
专题:
分析:(1)①在 A、B 中分别充入 lmolO2、2molSO2,使V (A )=V ( B ),A为恒温恒压容器,B为恒温恒容容器,反应前后气体体积减小的反应,A容器中压强大于B中的压强,反应速率大;
②若 A 容器中反应达到平衡后c(SO2 )是 a mol.L-1,在恒温下缓慢加压使容器的容积减小到平衡时的一半,浓度增大一倍,增大压强平衡正向进行方向;
(2)依据反应前后气体质量守恒计算反应后气体体积计算分析判断,转化率=
×100%;
(3)①依据气体总物质的量不变,比较加入量判断反应进行的方向;
②欲使起始反应维持向逆反应方向移动,即先气体物质的量增大的方向进行.
②若 A 容器中反应达到平衡后c(SO2 )是 a mol.L-1,在恒温下缓慢加压使容器的容积减小到平衡时的一半,浓度增大一倍,增大压强平衡正向进行方向;
(2)依据反应前后气体质量守恒计算反应后气体体积计算分析判断,转化率=
| 消耗量 |
| 起始量 |
(3)①依据气体总物质的量不变,比较加入量判断反应进行的方向;
②欲使起始反应维持向逆反应方向移动,即先气体物质的量增大的方向进行.
解答:
解:(1)①在 A、B 中分别充入 lmolO2、2molSO2,使V (A )=V ( B ),A为恒温恒压容器,B为恒温恒容容器,反应前后气体体积减小的反应,A容器中压强大于B中的压强,反应速率大,达到平衡状态需要时间短,t(A )<t ( B ),平衡时 S02 的转化率A中大,故答案为:<;>;
②若 A 容器中反应达到平衡后c(SO2 )是 a mol.L-1,在恒温下缓慢加压使容器的容积减小到平衡时的一半,浓度增大一倍,增大压强平衡正向进行方向;
(2)①依据反应前后气体质量守恒计算反应后气体体积V=
=1.6g.L-1,
V=80L
O2(气)+2SO2(气)?2SO3(气)
起始量(mol) 0.8 1.6 0
变化量(mol) x 2x 2x
平衡量(mol)0.8-x 1.6-2x 2x
物质的量之比等于气体体积之比,100:2.4=80:(2.4-x)
x=0.48mol
二氧化硫转化率=
×100%=60%
故答案为:80,60%;
②物质的量之比等于气体体积之比,80:0.8=120:n(O2)
a=1.2mol,b=2.4mol;
故答案为:1.2,2.4;
(3)①若 x=5.5时,在 B 中加入 6.5molO2、x moISO2、2.0molSO3,6.5+5.5+2=14mol>12mol,说明平衡正向进行,需降低温度才能使反应达到平衡时气体总物质的量为 12mol,证明正反应为放热反应;
故答案为:放热;
②若维持起始反应向逆反应方向移动,6.5+x+2<12mol,x<3.5mol,把,则 x 的取值范围是
②保持容器内气体总物质的量为12mol时,x+6.5+2.0=12,x=3.5,欲使起始反应维持向逆反应方向移动,向气体物质的量增大的方向进行,逆向进行彻底时,x取最小值,2+x+6.5+1=12,x=2.5,则x的取值范围为2.5<x<3.5,
故答案为:2.5<x<3.5.
②若 A 容器中反应达到平衡后c(SO2 )是 a mol.L-1,在恒温下缓慢加压使容器的容积减小到平衡时的一半,浓度增大一倍,增大压强平衡正向进行方向;
(2)①依据反应前后气体质量守恒计算反应后气体体积V=
| 0.8mol×32g/mol+1.6mol×64g/mol |
| V |
V=80L
O2(气)+2SO2(气)?2SO3(气)
起始量(mol) 0.8 1.6 0
变化量(mol) x 2x 2x
平衡量(mol)0.8-x 1.6-2x 2x
物质的量之比等于气体体积之比,100:2.4=80:(2.4-x)
x=0.48mol
二氧化硫转化率=
| 0.48mol |
| 0.8mol |
故答案为:80,60%;
②物质的量之比等于气体体积之比,80:0.8=120:n(O2)
a=1.2mol,b=2.4mol;
故答案为:1.2,2.4;
(3)①若 x=5.5时,在 B 中加入 6.5molO2、x moISO2、2.0molSO3,6.5+5.5+2=14mol>12mol,说明平衡正向进行,需降低温度才能使反应达到平衡时气体总物质的量为 12mol,证明正反应为放热反应;
故答案为:放热;
②若维持起始反应向逆反应方向移动,6.5+x+2<12mol,x<3.5mol,把,则 x 的取值范围是
②保持容器内气体总物质的量为12mol时,x+6.5+2.0=12,x=3.5,欲使起始反应维持向逆反应方向移动,向气体物质的量增大的方向进行,逆向进行彻底时,x取最小值,2+x+6.5+1=12,x=2.5,则x的取值范围为2.5<x<3.5,
故答案为:2.5<x<3.5.
点评:本题考查了化学平衡的计算应用,主要是恒温恒压恒温恒容容器的平衡影响分析判断,掌握基础是关键,题目难度较大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
可用来鉴别乙烯、四氯化碳、苯的方法是( )
| A、酸性高锰酸钾 | B、液溴 |
| C、硝化反应 | D、溴水 |
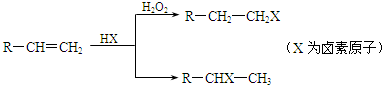
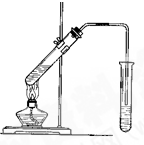 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.