题目内容
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
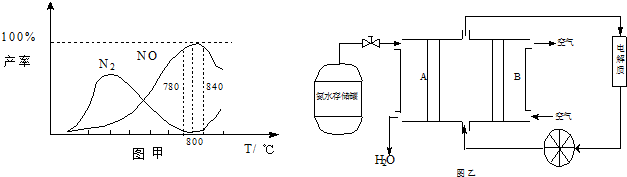
有关物质产率与温度的关系如甲图.
(1)由反应①②可知反应③N2(g)+O2(g)?2NO(g)的反应热△H= .
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在 .
(3)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为 .
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
有关物质产率与温度的关系如甲图.

(1)由反应①②可知反应③N2(g)+O2(g)?2NO(g)的反应热△H=
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在
(3)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(1)由盖斯定律,①-②可得目标热化学方程式,据此计算;
(2)从转化率的大小与温度的关系选择反应的适宜温度;
(3)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水.
(2)从转化率的大小与温度的关系选择反应的适宜温度;
(3)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水.
解答:
解:(1)①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
由盖斯定律,(①-②)×
可得N2(g)+O2(g)?2NO(g),故△H=
×[(-905kJ/mol)-(-1268kJ/mol)]=+181.5 kJ/mol,
故答案为:+181.5 kJ/mol;
(2)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择780~840℃,
故答案为:780~840℃;
(3)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O.
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
由盖斯定律,(①-②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+181.5 kJ/mol;
(2)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择780~840℃,
故答案为:780~840℃;
(3)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O.
点评:本题考查反应热的计算、化学平衡条件控制、原电池等,题目较为综合,(3)注意观察装置,结合总反应方程式解答,可以利用总反应式减去正极反应式书写.

练习册系列答案
相关题目
将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A、硫酸 纯碱 孔雀石[Cu2(OH)2CO3] |
| B、硝酸 烧碱 绿矾[FeSO4?7H2O] |
| C、醋酸 乙醇 碳酸钙 |
| D、盐酸 熟石灰 苛性钠 |
已知下列热化学方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
Fe2O3(s)+
CO(g)═
Fe3O4(s)+
CO2(g)△H=-15.73kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ?mol-1
则14g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
Fe2O3(s)+
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ?mol-1
则14g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
| A、-218kJ?mol-1 |
| B、-109kJ?mol-1 |
| C、+218kJ?mol-1 |
| D、+109kJ?mol-1 |
下列溶液能跟铜片反应,而且铜片的质量会减轻的是( )
| A、盐酸 |
| B、FeCl3溶液 |
| C、AgNO3溶液 |
| D、NaCl溶液 |
铜有两种常见的氧化物CuO和Cu2O.某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示.则下列分析正确的是( )
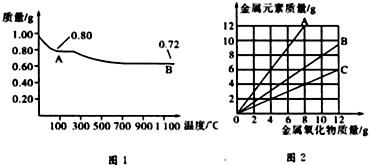

| A、图1中,A到B的过程中有0.01 mol电子发生了转移 |
| B、图1整个过程中共生成0.26 g水 |
| C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A |
| D、图1中A和B化学式分别为Cu2O和CuO |
若NA表示阿伏加德罗常数的数值,下列叙述中不正确的是( )
| A、16g O2与O3混合物中所含电子数为8NA |
| B、标准状况下,2.24LCH3OH分子中共用电子对数为0.5NA |
| C、6gSiO2晶体中硅氧共价键数为0.4NA |
| D、0.1mol13C18O中所含中子数为1.7NA |
下列金属中,不能从硫酸铜溶液里置换出铜的是( )
| A、Al | B、Zn | C、Fe | D、Na |
(B做)0.5L某浓度的氯化镁溶液中含1molCI-,下列说法不正确的是( )
| A、该溶液中氯化镁的物质的量浓度为1mol/L |
| B、CI--的物质的量浓度为2mol/L |
| C、含溶质氯化镁的质量为47.5g |
| D、取出0.25 L倒入烧杯中CI--的浓度为1mol/L |
 请用如图的装置设计一个实验,以测定SO2转化为SO3的转化率.
请用如图的装置设计一个实验,以测定SO2转化为SO3的转化率.