题目内容
17.下列相关实验示意图不能达到实验目的是( )| A. | 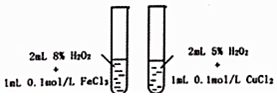 探究不同催化剂对H2O分解速率影响 | |
| B. | 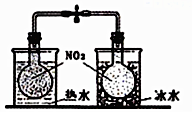 探究温度对2NO2?N2O2平衡影响 | |
| C. |  验证Cr2O72-+H2O?2CrO42-+H+平衡状态变化 | |
| D. |  验证钠和水反应的热效应 |
分析 A、研究催化剂对反应速率的影响,过氧化氢的质量分数要相同;
B、已知2NO2?N2O4△H<0,根据颜色的变化判断;
C、通过溶液颜色的变化,来判断;
D、钠与水反应U型右边的液面上升.
解答 解:A、研究催化剂对反应速率的影响,过氧化氢的质量分数要相同,故A错误;
B、已知2NO2?N2O4△H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故B正确;
C、通过溶液颜色的变化,来判断,如果溶液的颜色不变,说明达平衡状态,故C正确;
D、钠与水反应U型右边的液面上升,如果液面上升,说明发生反应,故D正确;
故选A.
点评 本题考查较为综合,涉及化学反应速率的影响因素、化学平衡移动等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
7.短周期主族元素X、Y、Z、W、R,它们的原子序数依次增大,元素X的原子半径是最小的,Y、R同主族且R原子核电荷数等于Y原子核电荷数的2倍,Z、W原子的最外层电子数之和与Y、R原子的最外层电子数之和相等.下列说法正确的是( )
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X与Y只能形成一种化合物 | |
| C. | W的最高价氧化物对应的水化物的酸性比R的强 | |
| D. | Z的简单气态氢化物的热稳定性比R的强 |
8.香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示.下列有关香天竺葵醇的说法错误的是( )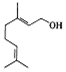

| A. | 分子中含有两种官能团 | |
| B. | lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构) | |
| C. | 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同 | |
| D. | 香天竺葵醇能发生加聚反应和氧化反应 |
5.某元素原子最外层只有1个电子,它与卤素相结合时,所形成的化学键( )
| A. | 一定是共价键 | B. | 一定是离子健 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 既含离子键又含共价键 |
12.药物阿司匹林可由水杨酸制得,它们的结构如图所示.下列有关说法正确的是( )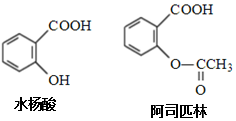

| A. | 阿司匹林分子中存在碳碳双键和碳氧双键 | |
| B. | 阿司匹林的分子式为C9H10O4,能与NaHCO3反应 | |
| C. | 水杨酸可以发生取代反应和加成反应 | |
| D. | 水杨酸的同分异构体中,含有羧基和羟基的只有2种 |
2.下列分子为极性分子的是( )
| A. | BF3 | B. | NH3 | C. | SO3 | D. | CS2 |
9.某有机物X的结构简式如图所示,则下列说法正确的是( )
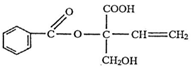

| A. | X的分子式为C12H14O5 | |
| B. | 1molX最多消耗1molNaOH | |
| C. | X在一定条件下能发生取代、加成、加聚、氧化等反应 | |
| D. | X苯环上的二氯代物有7种(不考虑立体异构) |
6.能用H++OH-=H2O表示的是( )
| A. | NH3•H2O+HNO3→NH4NO3+H2O | B. | CH3COOH+KOH→CH3COOK+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | 2HCl+Ca(OH)2→CaCl2+2H2O |