题目内容
1.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
分析 A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+;
B.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4;
C.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4.
解答 解:解:A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol•L-1,故A错误;
B.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol•L-1,故B错误;
C.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离等于水解,即c(H+)=c(OH-),存在c(Na+)=2c(C2O42-)+c(HC2O4- ),故C正确;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4- ),故D错误;
故选C.
点评 本题考查溶液中离子大小比较,题目难度中等,明确溶液中的溶质是解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
9.下列关于元素的叙述正确的是( )
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
12.下列用电子式表示的形成过程正确的是( )
| A. | H×+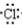 → →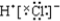 | B. | Na×+ → →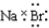 | ||
| C. |  | D. |  |
9.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 氢氧化铝、碳酸氢钠都可用于治疗胃酸过多 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 | |
| D. | 用化纤面料替代棉质面料,以减少二氧化碳的排放 |
16.有一无色溶液,可能含有Fe3+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:取部分溶液,加入适量Na2O2固体,产生气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分减少;另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有A13+、Mg2+、NH4+、Cl- | B. | 肯定有Al3+、Mg2+、SO42- | ||
| C. | 肯定没有NH4+、HCO3-、MnO4- | D. | 肯定有Al3+、Mg2+、HCO3- |
6.有两份等质量NaHCO3固体,将第一份充分加热,第二份不变,然后分别与足量盐酸反应,则下列叙述正确的是( )
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸前者多 | D. | 放出的CO2,第一份为第二份的一半 |
13.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 35Cl与37Cl与得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
10.下列说法正确的是( )
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 为了使实验现象明显,在做吸氧腐蚀实验时,不能用没有处理过的镀锌铁皮代替生铁 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
11.下列无色溶液中的离子能大量共存的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | OH-、K+、HCO3-、SO32- | ||
| C. | H+、Mg2+、Cl-、Br- | D. | Al3+、NH4+、OH-、NO3- |