题目内容
8.现有a mol/L 的NaX和b mol/L的NaY两种盐溶液.下列说法正确的是( )| A. | 若a=b且c(X-)=c(Y-)+c(HY),则HX为强酸 | |
| B. | 若a=b且pH(NaX)>pH(NaY),则c(X-)+c(OH-)>c(Y-)+c(OH-) | |
| C. | 若a>b且c(X-)=c(Y-),则酸性HX>HY | |
| D. | 若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化) |
分析 A.完全电离的酸是强酸;
B.根据电荷守恒和物料守恒判断;
C.酸的酸性越强,其酸根离子的水解能力越小;
D.根据物料守恒判断.
解答 解:A.若a=b,且c(X-)=c(Y-)+c(HY),说明HX完全电离,所以能说明HX为强酸,故A正确;
B.若a=b且 pH(NaX)>pH(NaY),根据电荷守恒得c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒得两种溶液中c(Na+)相等,根据溶液的PH知,X-的水解程度大于Y-,所以NaX中氢离子浓度小于NaY,所以c(X-)+c(OH-)<c(Y-)+c(OH-),故B错误;
C.若a>b且c(X-)=c(Y-),说明X- 的水解程度大于Y-,酸根离子水解程度越大,其相应酸的酸性越弱,则酸性HX<HY,故C错误;
D.若两溶液等体积混合,钠离子不水解,但溶液体积增大一倍,所以则c(Na+)=$\frac{a+b}{2}$mol/L,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点及弱酸酸性强弱与酸根离子水解程度的关系是解本题关键,易错选项是D,注意溶液体积变大,为易错点,题目难度不大.

练习册系列答案
相关题目
4.将乙烯通入溴的CCl4溶液中.下列说法正确的是( )
| A. | 溶液褪色 | B. | 有沉淀物生成 | C. | 生成物属于烃 | D. | 产物含有双键 |
19.下列物质中,含有非极性共价键的离子化合物的是( )
| A. | NH4NO3 | B. | Cl2 | C. | H2O2 | D. | Na2O2 |
16.化学与生活密切相关.请判断下列说法是否正确(填“对”或“错”).
①纤维素作为人类的营养物质,在人体内具有重要的生理功能.对
②钢铁在潮湿的空气中被腐蚀,主要是在钢铁表面发生了电化学腐蚀的原因.对.
①纤维素作为人类的营养物质,在人体内具有重要的生理功能.对
②钢铁在潮湿的空气中被腐蚀,主要是在钢铁表面发生了电化学腐蚀的原因.对.
20.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.资料显示:氯化铁为共价化合物.
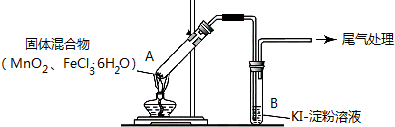
实验操作和现象:
(1)现象i中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液分别检验现象 ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
①方案1 的洗气瓶C中盛放的试剂是饱和NaCl溶液.
②方案2 中检验 Fe2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A中产物分离得到Fe2O3和MnCl2,A中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液分别检验现象 ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
②方案2 中检验 Fe2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A中产物分离得到Fe2O3和MnCl2,A中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
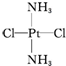 ,黄绿色固体
,黄绿色固体 .
.
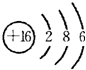 ,A的电子式
,A的电子式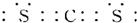 .
.