题目内容
下列说法中,正确的是( )
| A、在标准状况下,11g CO2和 5.6L N2所含分子数相同 |
| B、80g NaOH溶解在1L水中,得到溶液的物质的量浓度为2mol?L-1 |
| C、标准状况下,22.4L水中所含的分子数约为6.02×1023 |
| D、标准状况下,20mL NH3跟60mL N2所含分子个数比为1:3 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标况下,气体摩尔体积相等,11g CO2的物质的量=
=0.25mol,5.6L N2的物质的量=
=0.25mol,再结合N=nNA判断;
B.80gNaOH的物质的量=
=2mol,根据C=
判断;
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体;
D.标况下,气体的体积之比等于其物质的量之比,再结合N=nNA判断.
| 11g |
| 44g/mol |
| 5.6L |
| 22.4L/mol |
B.80gNaOH的物质的量=
| 80g |
| 40g/mol |
| n |
| V |
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体;
D.标况下,气体的体积之比等于其物质的量之比,再结合N=nNA判断.
解答:
解:A.标况下,气体摩尔体积相等,11g CO2的物质的量=
=0.25mol,5.6L N2的物质的量=
=0.25mol,根据N=nNA知,二者的分子数之比等于其物质的量之比为1:1,故A正确;
B.80gNaOH的物质的量=
=2mol,根据C=
知,V知溶液体积不是溶剂体积,80gNaOH溶于1L水中溶液的体积大于1L,所以氢氧化钠的物质的量浓度小于2mol/L,故B错误;
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体,水是液体,气体摩尔体积对其不适用,故C错误;
D.标况下,气体的体积之比等于其物质的量之比=1:3,再结合N=nNA知,其分子数之比等于其物质的量之比=1:3,故D正确;
故选AD.
| 11g |
| 44g/mol |
| 5.6L |
| 22.4L/mol |
B.80gNaOH的物质的量=
| 80g |
| 40g/mol |
| n |
| V |
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体,水是液体,气体摩尔体积对其不适用,故C错误;
D.标况下,气体的体积之比等于其物质的量之比=1:3,再结合N=nNA知,其分子数之比等于其物质的量之比=1:3,故D正确;
故选AD.
点评:本题考查了阿伏伽德罗定律及其推论,明确基本公式中各个物理量的含义是解本题关键,再结合气体摩尔体积的适用范围及适用条件分析解答,易错选项是B.

练习册系列答案
相关题目
下列反应的能量变化与其他三项不相同的是( )
| A、铝粉与氧化铁的反应 |
| B、氯化铵与氢氧化钡的反应 |
| C、锌片与稀硫酸反应 |
| D、钠与冷水反应 |
有一种高分子材料称为“塑料王”,它的成分是( )
| A、聚乙烯 | B、聚苯乙烯 |
| C、聚四氟乙烯 | D、聚氨酯树脂 |
在一定温度下发生可逆反应A(g)+3B(g)?2C(g),下列叙述中,不能判断该反应达到平衡的是
(1)C生成速率与C分解速率相等.
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化.
(4)单位时间内消耗amolA,同时生成3amolB
(5)A、B、C的分子数之比为1:3:2.
(6)混合气体的物质的量不再变化.( )
(1)C生成速率与C分解速率相等.
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化.
(4)单位时间内消耗amolA,同时生成3amolB
(5)A、B、C的分子数之比为1:3:2.
(6)混合气体的物质的量不再变化.( )
| A、(2)(5) |
| B、(1)(4)(6) |
| C、(2)(4) |
| D、(3)(4) |
在NH4Cl溶液中,下列关系正确的是( )
| A、c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
| B、c (NH4+)>c (Cl-)>c (H+)>c (OH-) |
| C、c (NH4+)=c (Cl-)>c (H+)=c (OH-) |
| D、c (Cl-)=c (NH4+)>c (H+)>c (OH-) |
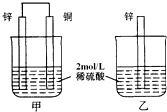 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
今有pH相同的硫酸和醋酸各100mL,将足量的镁条分别加入到硫酸溶液和醋酸溶液中,关于反应的叙述正确的是( )
| A、因为硫酸是强电解质,在水溶液中完全电离,所以刚开始其反应速率更快 |
| B、整个反应过程中两者的反应速率相同 |
| C、镁与硫酸反应产生的氢气比醋酸与镁反应产生的氢气少 |
| D、硫酸的物质的量浓度大于醋酸 |
某化学反应过程中的能量变化关系如图所示,下列结论正确的是( )


| A、该反应可能是乙醇燃烧反应 |
| B、该反应的逆反应是吸热反应 |
| C、该反应可能是碳酸钙分解反应 |
| D、需加热的化学反应一定是吸热反应 |