题目内容
2.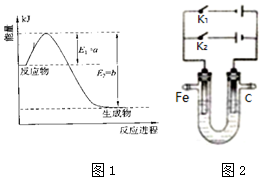 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.①图1是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1.(△H的数值用含字母a、b的代数式表示)
②在25°C时,将x mol•L-1的氨水与y mol•L-1的盐酸等体积混合,反应后溶液显中性,则反应后的溶液中:c(NH4+)=c(Cl-)(填“>”、“<”或“=”)
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25°C时,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1的硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是白色沉淀转变为黄色沉淀,产生该现象原因是(用离子方程式表示)AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
(3)图2为一电化学装置,电极分别为铁棒和碳棒.U形管中盛有电解质溶液.
①若U形管中盛有饱和食盐水,打开K2,闭合K1,铁棒为阴 极,碳棒上的电极反应式为2Cl--2e-=Cl2↑.
②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子.闭合K2,打开K1,阳极区所发生的反应有:Fe-2e-=Fe2+和6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O (写离子反应方程式)
分析 (1)①由图可知,合成氨为放热反应,且生成1mol氨气时放热为(b-a)kJ,结合物质的状态及焓变书写化学方程式;
②反应后溶液显中性,c(H+)=c(OH-),结合电荷守恒式分析;
(2)发生沉淀的转化,向Ksp更小的方向移动;
(3)①若U形管中盛有饱和食盐水,打开K2,闭合K1,Fe与电源负极相连为阴极,阳极上氯离子失去电子;
②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子.闭合K2,打开K1,Fe与电源正极相连为阳极,阳极上Fe失去电子,且亚铁离子与Cr2O72-发生氧化还原反应.
解答 解:(1)①由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ•mol-1;
②将n mol•L-1的氨水与m mol•L-1的盐酸等体积混合,反应后的溶液呈中性,c(H+)=c(OH-),根据溶液的电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),可知c(NH4+)=c(Cl-),
故答案为:=;
(2)白色沉淀为AgCl,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是白色沉淀转变为黄色沉淀,发生离子反应为AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:白色沉淀转变为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
(3)①若U形管中盛有饱和食盐水,打开K2,闭合K1,Fe与电源负极相连为阴极,阳极上氯离子失去电子,阳极反应为2Cl--2e-=Cl2↑,
故答案为:阴;2Cl--2e-=Cl2↑;
②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子.闭合K2,打开K1,Fe与电源正极相连为阳极,阳极上Fe失去电子,且亚铁离子与Cr2O72-发生氧化还原反应,则阳极区所发生的反应有:Fe-2e-=Fe2+和6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
点评 本题考查较综合,涉及热化学方程式、酸碱混合、沉淀转化及电解,为高频考点,把握图中能量变化、电荷守恒、沉淀转化的原理、电极反应为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的应用,题目难度不大.

| A. | 2,3,3-三甲基丁烷 | B. | 2-乙基-2-丁烯 | ||
| C. | 4-羟基苯甲酸 | D. | 二乙醇(HOOC-COOH) |
①NaHSO4②Al2O3 ③NaHSO3 ④(NH4)2CO3.
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 饱和CO2溶液中:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CO32- |
| A. | 1-丁烯的键线式: | B. | 乙烯的分子式:CH2=CH2 | ||
| C. | -CHO的电子式: | D. | 丙烷分子的比例模型为: |
| A. | 硝基苯(硝酸) NaOH溶液 分液 | |
| B. | 乙烯(二氧化硫) 酸性高锰酸钾 洗气 | |
| C. | 乙酸乙酯(乙酸) NaOH溶液 蒸馏 | |
| D. | 苯(苯酚) 溴水 过滤 |
| A. | 氢氟酸可蚀刻玻璃说明氢氟酸具有强酸性 | |
| B. | 油脂的氢化说明油脂分子中含有不饱和键 | |
| C. | 维生素C常用作抗氧化剂说明它具有氧化性 | |
| D. | 汽车尾气中含有氮氧化物说明汽油中含有氮元素 |
 .
. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: