题目内容
1.下列关于氧化还原反应的叙述正确的是( )| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
分析 A.存在元素化合价变化的反应属于氧化还原反应;
B.反应中可能有多种元素的化合价发生变化;
C.在化学反应中可能所有元素的化合价都发生变化,也可能部分元素的化合价发生变化;
D.氧化还原反应中得失电子守恒.
解答 解:A、存在元素化合价变化的反应属于氧化还原反应,氧化还原反应中不一定有O元素参加,如氢气与氯气的反应,故A错误;
B、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O反应中各元素的化合价都发生变化;Cl2+H2O=HCl+HClO反应中只有氯元素的化合价变化,故B错误;
C、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O反应中各元素的化合价都发生变化,有两种元素的化合价发生变化,故C错误;
D、氧化还原反应中得失电子守恒,氧化还原反应中电子有得必有失,化合价有升必有降,故D正确.
故选D.
点评 本题考查了氧化还原反应,难度不大,注意在氧化还原反应中可能同一元素既被氧化又被还原,侧重于基本概念的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.一定量的铁粉与足量2mol/L盐酸反应,为了加快反应速率且不影响产生氢气的量,可向溶液中加入( ):
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧将铁粉改为铁片.
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧将铁粉改为铁片.
| A. | ②③④⑤⑥ | B. | ③⑤⑥ | C. | ①③⑤⑥⑦ | D. | ③⑤⑥⑧ |
12.下列关于Fe2+和Fe3+的叙述中,错误的是( )
| A. | Fe2+的水溶液为浅绿色 | |
| B. | Fe3+的水溶液为黄色 | |
| C. | Fe3+具有氧化性,Fe2+具有还原性 | |
| D. | Fe3+溶液中滴入含KSCN-的溶液,立即出现红色沉淀 |
9.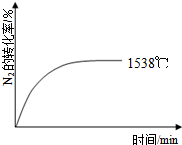 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
①该反应的△H>0.(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
16.配制250mL1mol/L的HCl溶液,需要10mol/L HCl溶液的体积为( )
| A. | 10mL | B. | 15mL | C. | 25mL | D. | 30mL |
13.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择不正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙酸乙酯(乙酸) | NaOH | 分液 |
| C | CH3CH2OH (H2O) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.下列除去杂质的方法错误的是( )
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CO2中混有的HCl:将气体通过饱和Na2CO3溶液 |
11.下列关于钠及其化合物的叙述错误的是?( )
| A. | 取用金属钠时,所需用品至少有小刀、镊子、滤纸、玻璃片 | |
| B. | 金属钠与Ca(HCO3)2溶液反应时,既有白色沉淀又有气体逸出 | |
| C. | 生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl | |
| D. | Na2O2与碱反应生成盐和水,所以Na2O2是碱性氧化物 |
