题目内容
以下性质的比较可能错误的是( )
| A、离子半径 H->Li+ |
| B、熔点 Al2O3>MgO |
| C、结合质子(H+)的能力 CO32->ClO- |
| D、密度 1-氯戊烷>1-氯己烷 |
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.具有相同电子排布的离子,原子序数大的离子半径小;
B.离子晶体中,离子的电荷越高,半径越小,晶格能越大,熔点越高,但氧化镁的离子性百分数远高于氧化铝的离子性百分数,相比之下,氧化铝离子性百分数的相对偏低,使离子键的削弱比Al3+电荷偏高,半径偏小对离子键的贡献要显著,导致了氧化铝熔点较氧化镁低.因此氧化铝熔点很高,但却低于氧化镁;
C.酸性越强,结合质子的能力越弱;
D.两者结构相似,烃基越大的密度小.
B.离子晶体中,离子的电荷越高,半径越小,晶格能越大,熔点越高,但氧化镁的离子性百分数远高于氧化铝的离子性百分数,相比之下,氧化铝离子性百分数的相对偏低,使离子键的削弱比Al3+电荷偏高,半径偏小对离子键的贡献要显著,导致了氧化铝熔点较氧化镁低.因此氧化铝熔点很高,但却低于氧化镁;
C.酸性越强,结合质子的能力越弱;
D.两者结构相似,烃基越大的密度小.
解答:
解:A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为H->Li+,故A正确;
B.离子晶体中,离子的电荷越高,半径越小,晶格能越大,熔点越高,但氧化铝的离子性百分比小于MgO中离子性百分比,则熔点为Al2O3<MgO,故B错误;
C.酸性是:HCO3-<HClO,所以结合质子(H+)的能力为CO32->ClO-,故C正确;
D.两者结构相似,1-氯戊烷的碳链短,其密度大,则密度为1-氯戊烷>1-氯己烷,故D正确;
故选B.
B.离子晶体中,离子的电荷越高,半径越小,晶格能越大,熔点越高,但氧化铝的离子性百分比小于MgO中离子性百分比,则熔点为Al2O3<MgO,故B错误;
C.酸性是:HCO3-<HClO,所以结合质子(H+)的能力为CO32->ClO-,故C正确;
D.两者结构相似,1-氯戊烷的碳链短,其密度大,则密度为1-氯戊烷>1-氯己烷,故D正确;
故选B.
点评:本题考查微粒性质的比较,为高频考点,涉及酸性、离子半径、晶体熔点、熔点比较等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,选项BD为解答的难点,题目难度不大.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、明矾溶液中滴加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O |
| C、小苏打溶液中加足量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、SO2通入FeCl3溶液中:SO2+Fe3++2H2O═SO42-+Fe2++4H+ |
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |
以下情况都有气体产生,其中不产生红棕色气体的是( )
| A、加热浓硝酸 |
| B、光照硝酸银 |
| C、加热硝酸钙 |
| D、加热溴化钾和浓硫酸混合物 |
 英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
下列说法正确的是( )
| A、甲苯是饱和烃,氯乙烯是不饱和烃 |
| B、石油的裂化产品能使溴水褪色 |
| C、蛋白质在CuSO4溶液中发生盐析 |
| D、油脂在NaOH溶液中水解生成高级脂肪酸和甘油 |
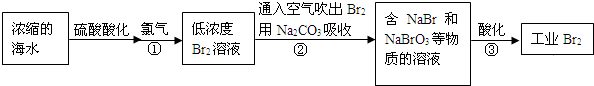
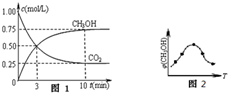 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.