题目内容
14.有一种有机物的键线式酷似牛形(如图所示),故称为牛式二烯炔醇(cowenyenynol).下列有关说法不正确的是( )
| A. | 该有机物的化学式为:C29H44O | |
| B. | 牛式二烯炔醇能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol牛式二烯炔醇最多可与6molBr2发生加成反应 | |
| D. | 牛式二烯炔醇分子内能发生消去反应 |
分析 由结构可知分子式,有机物中含有碳碳双键和碳碳三键,可发生加成、加聚和氧化反应,含有羟基,可发生取代反应,结合对应有机物的结构简答该题.
解答 解:A.由结构简式可知有机物分子式为C29H44O,故A正确;
B.分子中含碳碳双键,能使酸性高锰酸钾溶液褪色,故B正确;
C.含有2个碳碳双键和2个碳碳三键,1mol牛式二烯炔醇最多可与6molBr2发生加成反应,故C正确;
D.由于羟基邻位碳原子上没有氢原子,则不能发生消去反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意炔烃、烯烃、醇的性质,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
5.下列有关物质用途说法正确的是( )
| A. | 单质硅可用作光导纤维 | |
| B. | 氯气具有氧化性,干燥的氯气可以漂白有色物质 | |
| C. | 氧化铝熔点高、硬度大,常用于耐高温材料 | |
| D. | 二氧化硫能使品红溶液褪色,可以漂白所有有色物质 |
2.在一定条件下,RO3n-与R2-发生如下反应:RO3n-+2R2-+6H+═3R+3H2O,下列关于元素R的叙述中正确的是( )
| A. | R原子的最外层上有6个电子 | B. | RO3n-中的R只能被还原 | ||
| C. | HnRO3为强酸 | D. | R的单质既有氧化性又具有还原性 |
19.下列化合物在一定条件下,既能发生消去反应又能发生水解反应的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
6.能说明醋酸是弱电解质的事实是( )
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| C. | 醋酸溶液与碳酸钙反应,释放二氧化碳缓慢 | |
| D. | 0.1mol•L-1的CH3COOH溶液中,氢离子浓度约为0.001mol•L-1 |
3.反应N2+3H2?2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 增大H2的浓度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | N2与H2能100%转化为NH3 | D. | 升高温度能加快反应速率 |
4.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.以海带为原料提取碘的工艺流程如图1所示:
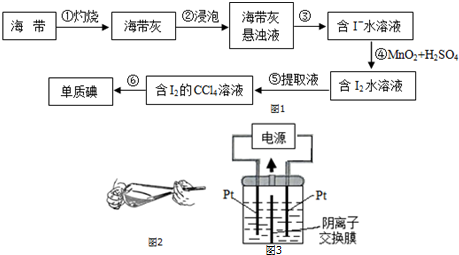
回答下列问题:
(1)步骤①灼烧海带时,除三脚架、坩埚、坩埚钳、酒精灯外,还需要用到的实验仪器有泥三角.
(2)步骤③的实验操作名称为过滤;步骤④中反应的离子方程式为2I-+MnO2+4H+═Mn2++I2+2H2O.
(3)下列有关步骤⑤中分液漏斗的使用方法表述合理的有bd(填字母)
a.分液漏斗使用前必须要检漏,只要旋塞处不漏水即可使用
b.萃取时振摇放气操作应如图2所示
c.静置分层后,先放出下层液体,然后继续从下口放出上层液体
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)步骤⑥中若采用蒸馏方法是不合适的,理由是碘易升华,会导致碘的损失.
(5)某兴趣小组用电位滴定法测定海带中碘的含量,测得的电动势(E)反映溶液中c(I-)的变化.该小组同学称取a g海带,经过步骤①②③操作得到含I-水溶液b mL,取100.00mL该溶液至滴定池,用0.01000mol•L-1的AgNO3标准溶液滴定,测得的部分数据如下表:
该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得出海带中碘元素的质量分数为$\frac{254b×1{0}^{-6}}{a}$×100%.
(6)以碘为原料,通过电解制备碘酸钾的实验装置如图3所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O;电解时保持电流恒定,升高温度,电解反应速率将不变(填“变大”“变小”“不变”).

回答下列问题:
(1)步骤①灼烧海带时,除三脚架、坩埚、坩埚钳、酒精灯外,还需要用到的实验仪器有泥三角.
(2)步骤③的实验操作名称为过滤;步骤④中反应的离子方程式为2I-+MnO2+4H+═Mn2++I2+2H2O.
(3)下列有关步骤⑤中分液漏斗的使用方法表述合理的有bd(填字母)
a.分液漏斗使用前必须要检漏,只要旋塞处不漏水即可使用
b.萃取时振摇放气操作应如图2所示
c.静置分层后,先放出下层液体,然后继续从下口放出上层液体
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)步骤⑥中若采用蒸馏方法是不合适的,理由是碘易升华,会导致碘的损失.
(5)某兴趣小组用电位滴定法测定海带中碘的含量,测得的电动势(E)反映溶液中c(I-)的变化.该小组同学称取a g海带,经过步骤①②③操作得到含I-水溶液b mL,取100.00mL该溶液至滴定池,用0.01000mol•L-1的AgNO3标准溶液滴定,测得的部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
(6)以碘为原料,通过电解制备碘酸钾的实验装置如图3所示.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O;电解时保持电流恒定,升高温度,电解反应速率将不变(填“变大”“变小”“不变”).
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: