题目内容
14.5.6g铁粉投入到足量的100mL2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是( )| A. | v(Fe)=0.5mol/(L•min) | B. | v(H2SO4)=0.5mol/(L•min) | ||
| C. | v(H2)=0.5mol/(L•min) | D. | v(FeSO4)=0.5mol/(L•min) |
分析 2min时铁粉刚好溶解,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,则消耗硫酸为0.1mol,生成硫酸亚铁、氢气均为0.1mol,结合v=$\frac{△c}{△t}$ 计算.
解答 解:2min时铁粉刚好溶解,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
A.Fe为纯固体,不能表示反应速率,故A错误;
B.消耗硫酸为0.1mol,则v(H2SO4)=$\frac{\frac{0.1mol}{0.1L}}{2min}$=0.5 mol/(L.min),故B正确;
C.该反应为溶液中的反应,无法表示氢气的浓度变化,故C错误;
D.v(FeSO4)=v(H2SO4)=$\frac{\frac{0.1mol}{0.1L}}{2min}$=0.5 mol/(L.min),故D正确;
故选BD.
点评 本题考查化学反应速率的计算及化学计量数与反应速率的关系,侧重反应中物质的状态及速率的计算公式的考查,注重基础知识的考查,选项AC为易错点,题目难度不大.

练习册系列答案
相关题目
5.下列表示物质结构的化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | NaCl的电子式: | ||
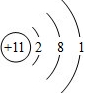
| C. | Cl-的结构示意图: | D. | CH4的比例模型: |
9.为了促进酯的水解,可以采取最有效的措施是( )
| A. | 增加酯的用量 | B. | 增加水的用量 | ||
| C. | 加热 | D. | 加入氢氧化钡溶液并加热 |
19.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后:c(H+)=c(CH3COO-)+c(OH-) |
6.将一定量的铁粉投入到FeCl3、CuCl2的混合溶液中,充分反应后仍有固体存在,则下列判断正确的是(已知氧化性:Fe3+>Cu2+)( )
| A. | 剩余固体中一定含Fe | B. | 剩余固体中一定含Fe和Cu | ||
| C. | 剩余固体中一定不含Cu | D. | 剩余固体中一定含Cu |
3.下列各组物质中,都是弱电解质的是( )
| A. | HBr、HCl、AgCl | B. | CaCO3、CH3COONa、NaHSO4 | ||
| C. | HClO、HF、NH3 | D. | H2CO3、CH3COOH、H2S |
4.下列铁的化合物不可能由化合反应直接制得的是( )
| A. | FeCl2 | B. | Fe2(SO4)3 | C. | FeCl3 | D. | FeS |
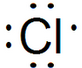 .
.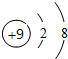 .
. D2-的电子式为
D2-的电子式为 .
. ;Z元素原子的电子式为
;Z元素原子的电子式为 .
.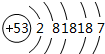 .
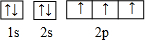
.
 .
.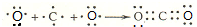 ,1molce2含有σ键的数目为6.02×1023.
,1molce2含有σ键的数目为6.02×1023.