题目内容
现有常温下的四份溶液:下列说法正确的是( )
①0.01mol?L-1CH3COOH溶液 ②0.01mol?L-1的盐酸 ③pH=12的氨水 ④pH=12的NaOH溶液.
①0.01mol?L-1CH3COOH溶液 ②0.01mol?L-1的盐酸 ③pH=12的氨水 ④pH=12的NaOH溶液.
| A、将②③混合,若pH=7,则消耗溶液的体积:②>③ |
| B、①中水的电离程度最小,③中水的电离程度最大 |
| C、将①④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释到原体积相同倍数后,溶液的pH:③>④,②>① |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.一水合氨是弱碱,等体积混合时溶液呈碱性,所以盐酸体积大于氨水溶液的体积;
B.酸碱对水的电离起到抑制作用,酸中的氢离子或碱中的氢氧根离子浓度越大,抑制程度越大;
C.将①、④混合体积不同混合后溶液不一定成碱性,中性溶液中也存在c(CH3COO-)>c(H+);
D.稀释相同倍数,弱电解质存在电离平衡.
B.酸碱对水的电离起到抑制作用,酸中的氢离子或碱中的氢氧根离子浓度越大,抑制程度越大;
C.将①、④混合体积不同混合后溶液不一定成碱性,中性溶液中也存在c(CH3COO-)>c(H+);
D.稀释相同倍数,弱电解质存在电离平衡.
解答:
解:A.②③若等体积混合后溶液呈碱性,若有pH=7,则消耗溶液的体积为②>③,故A正确;
B.②③④溶液是强酸、弱碱、强碱,溶液中氢离子和氢氧根离子浓度相同,对水的电离抑制程度相同,①溶液中的氢离子浓度,对水抑制程度小,所以①水的电离程度最小,②③④溶液中水的电离程度一样大,故B错误;
C.若将①、④等体积混合,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,有c(CH3COO-)>c(H+),若混合后溶液呈中性时存在C(Na+)=c(CH3COO-)>C(OH-)=c(H+),故C错误;
D.将四份溶液稀释相同倍数后溶液的pH:氨水存在电离平衡,溶液中氢氧根离子浓度大于氢氧化钠溶液中氢氧根离子,③>④,同浓度醋酸和盐酸稀释相同倍数,醋酸存在电离平衡,醋酸溶液中氢离子浓度小于盐酸溶液中的氢离子浓度,所以溶液pH为①>②,故D错误.
故选A.
B.②③④溶液是强酸、弱碱、强碱,溶液中氢离子和氢氧根离子浓度相同,对水的电离抑制程度相同,①溶液中的氢离子浓度,对水抑制程度小,所以①水的电离程度最小,②③④溶液中水的电离程度一样大,故B错误;
C.若将①、④等体积混合,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,有c(CH3COO-)>c(H+),若混合后溶液呈中性时存在C(Na+)=c(CH3COO-)>C(OH-)=c(H+),故C错误;
D.将四份溶液稀释相同倍数后溶液的pH:氨水存在电离平衡,溶液中氢氧根离子浓度大于氢氧化钠溶液中氢氧根离子,③>④,同浓度醋酸和盐酸稀释相同倍数,醋酸存在电离平衡,醋酸溶液中氢离子浓度小于盐酸溶液中的氢离子浓度,所以溶液pH为①>②,故D错误.
故选A.
点评:本题考查了弱电解质的电离平衡应用,为高频考点,侧重于学生的分析能力的考查,主要是对水的电离影响,溶液酸碱性的判断,溶液稀释的PH变化,关键是酸碱反应后溶液酸碱性的判断.

练习册系列答案
相关题目
能表明NH3?H2O是弱电解质的叙述是( )
| A、NH3?H2O的导电性比NaOH溶液弱得多 |
| B、0.1 mol?L-1NH3?H2O的pH大于7 |
| C、(NH4)2SO4的水溶液,其pH小于7 |
| D、5 mL1 mol?L-1的NH3?H2O跟10 mL0.5 mol?L-1的HCl恰好完全反应 |
NO、NO2可被氨水溶液吸收(6NO+4NH3→5N2+6H2O;6NO2+8NH3→7N2+12H2O).现有NO与NO2(不含N2O4)混合气体90mol被30%的氨水4.45×103g完全吸收,产生78mol氮气.吸收后氨水密度为0.980g/cm3.则( )
| A、原混合气体的平均组成为NO1.1 |
| B、原氨水的浓度约为17.3mol/L |
| C、吸收后氨水的浓度约为2.4mol/L |
| D、吸收后氨水的质量分数约为0.5 |
 pH=11的X、Y两种碱溶液各5mL,分别稀释至500mL,其pH随溶液体积(V)变化的关系如图所示,下列说法正确的是( )
pH=11的X、Y两种碱溶液各5mL,分别稀释至500mL,其pH随溶液体积(V)变化的关系如图所示,下列说法正确的是( )| A、稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 |
| B、若X、Y是一元碱,等物质的量浓度的盐酸盐溶液,Y的pH大 |
| C、完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积:V(X)>V(Y) |
| D、若X、Y都是一元弱碱,则a的值一定大于9 |
两种金属组成的合金65g,与氯气完全反应,消耗氯气71g,则该合金的组成可能是( )
| A、Cu、Zn |
| B、Na、Hg |
| C、Fe、Ca |
| D、Cu、Ca |

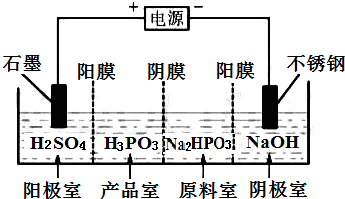 亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3. 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为: