题目内容
8.有关物质的转化关系如图所示(部分生成物和反应条件已略去).D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝,G呈黄绿色,H在空气中含量最高;C的摩尔质量为32g•mol-1;E为难溶性碱.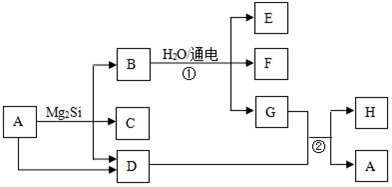
(1)C的化学式为SiH4;
(2)H的电子式
 ;
;(3)写出反应①的离子方程式Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓;
(4)写出反应②的化学方程式8NH3+3Cl2═N2+6NH4Cl.
分析 D能使湿润的红色石蕊试纸变蓝,应为NH3,G呈黄绿色,为Cl2,H在空气中含量最高,应为N2,C的摩尔质量为32g•mol-1,由转化关系可知应含有Si元素,则C为SiH4,B应为MgCl2,则E为Mg(OH)2,F为H2,A为NH4Cl,以此解答该题.
解答 解:(1)由以上分析可知C为SiH4,故答案为:SiH4;
(2)H为N2,电子式为 ,故答案为:
,故答案为: ;
;
(3)反应①为氯化镁溶液的电解,离子方程式为Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,
故答案为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓;
(4)反应②为氯气和氨气的反应,化学方程式为8NH3+3Cl2═N2+6NH4Cl,故答案为:8NH3+3Cl2═N2+6NH4Cl.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,本题注意把握氯化铵与硅化镁反应的特点,为解答该题的关键,注意把握物质的特征性质,难度中等.

练习册系列答案
相关题目
19.已知:KClO3+6HCl(浓)→KCl+3Cl2+3H2O,氧化产物与还原产物物质的量之比为( )
| A. | 5:1 | B. | 1:5 | C. | 6:1 | D. | 1:6 |
16.相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,下列数值前者大于后者的是( )
| A. | OH-的物质的量 | B. | CO32-的物质的量 | C. | c(HCO3-) | D. | 由水电离的 c(OH-) |
3.下列有关苯、乙酸、乙醇说法正确的是( )
| A. | 都易溶于水 | B. | 苯易于液溴发生加成反应 | ||
| C. | 乙酸溶液的pH小于7 | D. | 乙醇不能与金属钠反应 |
5.N2与O2的混合气体的密度对氢气的相对密度为14.5,则N2在混合气体中的质量分数为( )
| A. | 72.4% | B. | 75% | C. | 50% | D. | 80.5% |
9.关于硝酸的说法不正确的是( )
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 | |
| B. | 浓HNO3见光易分解,所以应保存在棕色试剂瓶中 | |
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| D. | 常温下,向浓⑤中投入Fe片,无明显现象 |
10.四种短周期元素在周期表中的相对位置如表所示.X元素最常见气态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物.下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 简单离子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | 最常见气态氢化物的沸点:Y>X>Z | |
| D. | 最高价氧化物对应的水化物酸性:Z>W |
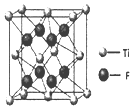 光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得.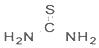 )中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.
)中C原子轨道的杂化类型为.1mol硫脲中含有σ键的数目为7mol.