题目内容
19.已知:KClO3+6HCl(浓)→KCl+3Cl2+3H2O,氧化产物与还原产物物质的量之比为( )| A. | 5:1 | B. | 1:5 | C. | 6:1 | D. | 1:6 |
分析 在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中反应中只有Cl元素化合价发生变化,KClO3中氯元素的化合价由+5价变为0价,HCl中Cl元素化合价由-1价升高到0价,据此分析解答.
解答 解:在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,生成0.5Cl2为还原产物,HCl中Cl元素化合价由-1价升高到0价,所以HCl是还原剂,生成2.5Cl2为氧化产物,则氧化产物和还原产物的物质的量之比是5:1,故选A.
点评 本题考查氧化还原反应,为高频考点,根据反应中元素化合价变化为解答的关键,侧重基本概念的考查,题目难度不大.

练习册系列答案
相关题目
10.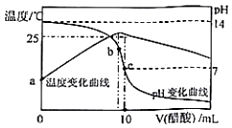 在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol/L醋酸溶液滴入10mL1.0mol/LNaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | n>1.0 | B. | a点Kw=1.0×10-14 | ||
| C. | 水的电离程度:c>b | D. | b点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
7.设NA为阿伏伽德罗常数值,下列有关叙述正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 1 L pH=1的硫酸溶液中含有的H+数为0.2NA | |
| C. | 由1 mol NH4Cl和少量氨水形成的中性溶液中,NH4+数目小于NA个 | |
| D. | 在标准状况下,2.24L的C12溶于水,充分反应后转移电子数一定为0.1NA |
14.下列有关性质的比较,错误的是( )
| A. | 酸性:H2SO4>H2CO3 | B. | 沸点:CBr4>CCl4 | ||
| C. | 碱性:Al(OH)3>NaOH | D. | 热稳定性:HF>HCl |
4.下列变化不需要破坏化学健的是( )
| A. | 加热氯化铵固体 | B. | 干冰气化 | C. | 石油裂化 | D. | 氯化氢溶于水 |
11.不能通过化合反应得到的是( )
| A. | NH4Cl | B. | Cu2S | C. | FeCl2 | D. | Al(OH)3 |
1.中学化学中所学很多“规律”都有其特定的使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据周期元素的原子半径变化趋势,推出Al的半径比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同主族元素化学性质相似规律,推出Li在空气中完全燃烧的产物是Li2O2 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入Na2SiO3溶液中能生成H2SiO3 |

 ;
; ;
; .
.
 ;
;