题目内容
16.相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,下列数值前者大于后者的是( )| A. | OH-的物质的量 | B. | CO32-的物质的量 | C. | c(HCO3-) | D. | 由水电离的 c(OH-) |
分析 相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,碳酸根离子浓度越大水解程度越小,溶液碱性越强.
解答 解:A.碳酸根离子浓度越小水解程度越大,生成氢氧根离子物质的量越大,相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,OH-的物质的量前者大于后者,故A正确;
B.相同温度时 100mL 0.01mol/L 的碳酸钠溶液与 10mL 0.1mol/L 的碳酸钠溶液相比,CO32-的物质的量前者小于后者,故B错误;
C.碳酸钠浓度越大水解程度越小,但离子浓度大,前者小于后者,故C错误;
D.碳酸钠浓度越大水解程度越小,但离子浓度大,由水电离的 c(OH-)前者小于后者,故D错误;
故选A.
点评 本题考查了盐类水解原理、越小水解的因素和微粒数、微粒浓度变化分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.有机物甲、乙的键线式结构如图所示.下列说法不正确的是( )
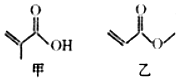
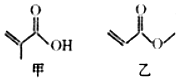
| A. | 甲和乙互为同分异构体 | |
| B. | 甲和乙都能发生取代反应 | |
| C. | 甲和乙中都有3种不同化学环境的氢 | |
| D. | 1mol甲和1mol乙都能与2molH2发生加成反应 |
7.设NA为阿伏伽德罗常数值,下列有关叙述正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 1 L pH=1的硫酸溶液中含有的H+数为0.2NA | |
| C. | 由1 mol NH4Cl和少量氨水形成的中性溶液中,NH4+数目小于NA个 | |
| D. | 在标准状况下,2.24L的C12溶于水,充分反应后转移电子数一定为0.1NA |
4.下列变化不需要破坏化学健的是( )
| A. | 加热氯化铵固体 | B. | 干冰气化 | C. | 石油裂化 | D. | 氯化氢溶于水 |
11.不能通过化合反应得到的是( )
| A. | NH4Cl | B. | Cu2S | C. | FeCl2 | D. | Al(OH)3 |
1.实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率减慢的是( )
| A. | 向稀硫酸中加水 | B. | 增加锌粒的量 | C. | 用锌粉代替锌粒 | D. | 升高反应温度 |
17.下列实验操作正确且能达到预期目的是( )
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| C | 检验溴乙烷中的溴原子 | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
| D | 制备溴苯 | 苯、溴水和铁屑混合于带长导管的烧瓶中 |
| A. | A | B. | B | C. | C | D. | D |
18.环丙烷叉环丙烷结构为: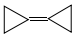 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 不可能是环丙烷的同系物 | ||
| C. | 与环己二烯(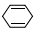 )是同分异构体 )是同分异构体 | D. | 所有的原子均在同一平面内 |
 ;
;