题目内容
5.将2mol N2和4mol H2充入2L密闭容器中进行合成NH3反应,2min后测得生成NH31.6mol,求2min内各物质的反应速率.分析 2分钟内v(NH3)=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算出用氨气表示的反应速率;同一可逆反应同一时间内,各物质的反应速率之比等于其计量数之比,据此计算氮气、氢气的平均反应速率,据此分析解答.
解答 解:2min后测得生成NH31.6mol,则2min内用NH3表示的物质的反应速率为:v(NH3)=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol•L-1•min-1;
化学反应速率与计量数成正比,根据反应N2+3H2=2NH3可知,v(N2)=$\frac{1}{2}$×v(NH3)=$\frac{1}{2}$×0.4mol•L-1•min-1=0.2mol•L-1•min-1;
v(N2)=$\frac{1}{2}$×v(NH3)=$\frac{1}{2}$×0.4mol•L-1•min-1=0.2mol•L-1•min-1,
答:2min内各物质的平均反应速率分别为:v(NH3)=0.4mol•L-1•min-1、v(N2)=0.2mol•L-1•min-1、v(N2)=$\frac{1}{2}$×v(NH3)=0.2mol•L-1•min-1.
点评 本题考查了化学反应速率的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Y-电子数之差为8.下列推测不正确的是( )
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
17.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
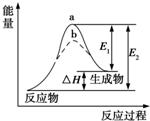

| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
13.下列操作能达到实验目的是( )
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH的乙醇溶液共热产生的气体通入溴水中,溶液褪色说明有乙烯生成 | |
| C. | 向稀氨水中滴加硝酸银溶液配得银氨溶液 | |
| D. | 溴乙烷与氢氧化钠溶液共热后,加入硝酸银溶液检验Br- |
17.下列物质中,化学式能真正表示该物质分子组成的是( )
| A. | Na2O | B. | SiO2 | C. | KCl | D. | H2SO4 |
14.下列说法不正确的是( )
| A. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7 | |
| B. | 把镁粉加入FeCl3饱和溶液中,有气体和红褐色沉淀生成 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法 | |
| D. | 盐类水解反应的逆反应是酸碱中和反应,但酸碱中和反应不一定是可逆反应. |

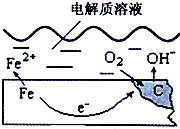 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为: