题目内容
6.莫尔盐[(NH4)2Fe(SO4)2•6H2O]在定量分析中常用作标定高锰酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等.回答下列问题:
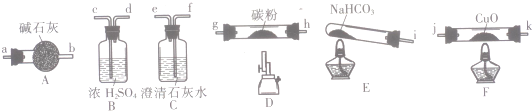
(1)甲组同学按照如图1所示的装置,通过实验检验莫尔盐晶体强热时的分解产物.装置C中可观察到的现象是溶液变红,由此可知莫尔盐晶体分解的产物中有NH3.装置B的主要作用是吸收分解产生的酸性气体.
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2.为进行验证,选用甲组实验中的装置A和如图2所示的部分装置进行实验.
①乙组同学的实验中,装置依次连接的合理顺序为A→G→D→B→C→F.
②装置D中足量盐酸的作用是吸收氨气并将溶液酸化,排除SO2的干扰;含有SO3的实验现象是D中有白色沉淀;含有SO2的实验现象是B中品红褪色.
(3)称取1.96g莫尔盐晶体,制成溶液,用未知浓度的KMnO4酸性溶液进行滴定.
①滴定时,将KMnO4酸性溶液装在酸式(填“酸式”或“碱式”)滴定管.试写出该滴定过程中的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②判断该反应到达滴定终点的现象为当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点;
(4)设计实验证明:莫尔盐是否已氧化变质取少量晶体溶于水,滴入KSCN溶液,若溶液变红,说明莫尔盐已氧化变质,反之莫尔盐未变质.
分析 (1)莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色;
(2)①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,据此答题;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色;
(3)①高锰酸钾溶液碱与偶强氧化性应在酸式滴定管中;莫尔盐中的亚铁离子可被高锰酸钾溶液氧化成铁离子,高锰酸根被还原成锰离子,根据电荷守恒和元素守恒书写离子方程式;
②利用高锰酸钾溶液紫红色指示反应终点,滴入最后一滴KMnO4酸性溶液滴下时,溶液变成紫色且不发生变化证明反应达到终点;
(4)莫尔盐氧化变质会产生铁离子,可以通过检验样品中是否含有铁离子判断是否变质.
解答 解:(1)莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色,所以装置C 中可观察到的现象是溶液变红,由此可知莫尔盐晶体分解的产物中有 NH3.装置B的主要作用是 吸收分解产生的酸性气体,
故答案为:溶液变红;NH3;吸收分解产生的酸性气体;
(2)①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、D、B、C、F,
故答案为:G、D、B、C、F;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色,所以装置D中足量盐酸的作用是 吸收氨气并将溶液酸化,排除SO2的干扰;含有SO3的实验现象是 D中有白色沉淀;含有SO2的实验现象是B中品红褪色,
故答案为:吸收氨气并将溶液酸化,排除SO2的干扰;D中有白色沉淀;B中品红褪色;
(3)①高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,应盛放在酸式滴定管中,莫尔盐中的亚铁离子可被高锰酸钾溶液氧化成铁离子,高锰酸根被还原成锰离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:酸式;MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②利用高锰酸钾溶液紫红色指示反应终点,当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点,
故答案为:当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点;
(4)莫尔盐氧化变质会产生铁离子,可以通过检验样品中是否含有铁离子判断是否变质,实验操作为取少量晶体溶于水,滴入KSCN溶液,若溶液变红,说明莫尔盐已氧化变质;反之莫尔盐未变质,
故答案为:取少量晶体溶于水,滴入KSCN溶液,若溶液变红,说明莫尔盐已氧化变质,反之莫尔盐未变质.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,难度较大.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | Li、Na、K元素的金属性依次减弱 | |
| B. | P、S、Cl元素的最高正价依次降低 | |
| C. | Li、Be、B的原子最外层电子数依次减少 | |
| D. | Na+、Mg2+、Al3+的离子半径依次减少 |
| A. | 汽车尾气中的CO﹑NO等都是大气污染物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,且属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
请回答:
(1)按气流方向,各装置从左到右的连接顺序为icd;gh(或hg);ab;jk(或kj);fe尾气处理(填仪器接口的字母编号);
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集;
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O;
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示);
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
| A. | 100 mL、1 mol.L-1的AlCl3溶液中,含Al3+的数目为0.1 NA | |
| B. | 1mol 羟基中所含的电子数为10NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA | |
| D. | 2.8 g乙烯与一氧化碳的混合气体,所含分子数目为0.1 NA |
| A. | 酸性:H2SO4>H3AsO4>H3PO4 | |
| B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | |
| C. | 金属单质置换出氢的能力:Cs>Rb>K>Ca | |
| D. | 氧化性:F2>Cl2>S |
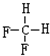 和
和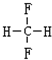
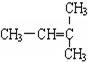 和CH2=CH-CH3
和CH2=CH-CH3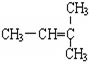 和
和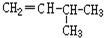



 .
. .
. +(2n-1)H2O.
+(2n-1)H2O. .
.