题目内容
11.某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成.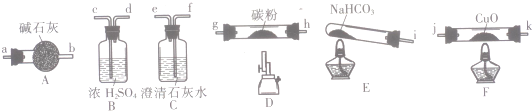
请回答:
(1)按气流方向,各装置从左到右的连接顺序为icd;gh(或hg);ab;jk(或kj);fe尾气处理(填仪器接口的字母编号);
(2)说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)该实验处理尾气的方法为点燃烧掉或用气囊收集;
(4)若去掉B装置,可能产生的影响为NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)将各装置按正确的顺序连接后进行实验.当反应结束后,F处硬质玻璃管中的固体全部变为红色.
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+.
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O;
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O.(用化学方程式表示);
[实验结论]根据上述实验结果,可知红色固体的成分为Cu(填化学式).
分析 (1)验证CO能还原CuO,并探究其还原产物的组成,利用的原理是一氧化碳还原氧化铜反应生成铜和二氧化碳,验证生成的二氧化碳用澄清石灰水,生成的产物为红色固体,先制备纯净的一氧化碳,依据装置图可知,装置E加热分解生成二氧化碳和水蒸气,通过装置B吸收水蒸气,通过装置D二氧化碳和碳反应生成一氧化碳,通过装置A中的碱石灰除去未反应的二氧化碳气体,得到纯净的一氧化碳气体,通过装置F加热发生反应,生成的气体二氧化碳通过装置C中的澄清石灰水检验,最后剩余一氧化碳气体不能排放到空气中,需要收集或点燃进行尾气处理;
(2)依据上述分析说明CO能还原CuO的实验现象应根据生成的红色固体和二氧化碳去产生的现象判断;
(3)实验过程中生成的尾气为一氧化碳,一氧化碳气体有毒不能排放到空气中需要点燃或收集;
(4)B装置是吸收生成的水蒸气,若去掉B装置水蒸气进入装置D会和碳反应生成氢气,氢气也会还原氧化铜来分析;
(5)Cu和Cu2O均为红色,所以红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O的混合物;
依据实验现象和物质性质分析,硝酸和铜、氧化亚铜都能发生反应,稀硫酸只和氧化亚铜发生反应.
解答 解:(1)验证CO能还原CuO,并探究其还原产物的组成,利用的原理是一氧化碳还原氧化铜反应生成铜和二氧化碳,验证生成的二氧化碳用澄清石灰水,生成的产物为红色固体,先制备纯净的一氧化碳,依据装置图可知,装置E加热分解生成二氧化碳和水蒸气,通过装置B吸收水蒸气,通过装置D二氧化碳和碳反应生成一氧化碳,通过装置A中的碱石灰除去未反应的二氧化碳气体,得到纯净的一氧化碳气体,通过装置F加热发生反应,生成的气体二氧化碳通过装置C中的澄清石灰水检验,最后剩余一氧化碳气体不能排放到空气中,需要收集或点燃进行尾气处理,按气流方向,各装置从左到右的连接顺序为icdgh(或hg)abjk(或kj)fe;
故答案为:cd;gh(或hg);ab;jk(或kj);fe;
(2)上述分析可知说明CO能还原CuO的实验现象为F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
故答案为:F处硬质玻璃管中的黑色固体变为红色,C处澄清石灰水变浑浊;
(3)实验过程中生成的尾气为一氧化碳,一氧化碳气体有毒不能排放到空气,该实验处理尾气的方法为点燃烧掉或用气囊收集;
故答案为:点燃烧掉或用气囊收集;
(4)B装置是吸收生成的水蒸气,若去掉B装置,NaHCO3分解产生的水蒸气进入装置D,高温能与碳粉反应生成H2 ,对实验产生干扰;
故答案为:NaHCO3分解产生的水蒸气高温能与碳粉反应生成H2,对实验产生干扰;
(5)Cu和Cu2O均为红色,所以红色固体的成分可能为:①Cu;②Cu2O;③Cu和Cu2O的混合物;Cu2O在酸性溶液中能生成Cu和Cu2+,分别取少量红色固体放人试管中,加入足量稀硝酸、振荡,试管内红色固体完全溶解,溶液变为蓝色,说明生成了铜离子,并有无色气体产生证明为一氧化氮,但铜和氧化亚铜都可以和硝酸发生反应,反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O,a实验不能确定红色固体成分;加入足量稀硫酸、振荡,试管内有红色固体,溶液不变色证明无氧化亚铜,红色固体为铜;
故答案为:Cu和Cu2O;a;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O;Cu.
点评 本题考查了实验验证生成物成分、实验探究物质组成的分析判断,主要是装置连接设计,物质性质的理解应用,掌握基础是关键,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案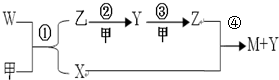
| B | C | D | |
| E |
(2)A、C、D三种元素组成的盐中,化学键类型为离子键、共价键
(3)乙的电子式为

(4)反应④的化学方程式为3NO2+H2O=2HNO3+NO,还原产物为NO
(5)W作火箭燃料时,氧化剂可以是Z,0.25mol的W气体完全和足量的Z气体反应生成乙和X,转移的电子为1mol.
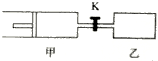 如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )| A. | 乙容器中SO2的转化率小于60% | |
| B. | 平衡时SO3的体积分数:甲>乙 | |
| C. | 打开K后一段时间.再次达到平衡.甲的体积为1.4 L | |
| D. | 平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,平衡向正反应方向移动 |
| 选项 | A | B | C | D |
| 实验 操作 | 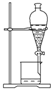 | 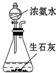 | 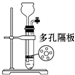 | 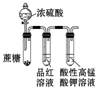 |
| 实验 目的 | 分离乙酸与乙酸乙酯的混合液 | 制取氨气 | 盐酸与碳酸钙反应,验证碳与氯的非金属性强弱 | 验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
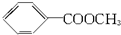
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 石墨和金刚石 | B. | 水和重水 | C. | 甲烷和丁烷 | D. | 氕和氚 |
 .
. 如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:
如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题: