题目内容
如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是: (写元素符号),最活泼的非金属单质为 (写化学式).
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的电子式是: .
(3)最高价氧化物是两性氧化物的元素是(写元素符号) ;写出它的氧化物与氢氧化钠溶液反应的离子方式 .
(4)元素①与⑥形成的化合物晶体类型为 晶体,元素③与⑦形成的化合物属于 化合物.(填“共价”或“离子”)
(5)可以验证④⑤两元素金属性强弱实验是 .
A.将在空气中放置已久的④和⑤的单质分别与热水反应
B.将除去氧化物薄膜的④与⑤的单质分别和热水作用,并滴人酚酞溶液
C.将除去氧化物薄膜的④与⑤的单质分别和2mL 1mol?L-1的盐酸反应
D.比较④与⑤两种元素的最高价氧化物的水化物的溶解性.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)最高价氧化物是两性氧化物的元素是(写元素符号)
(4)元素①与⑥形成的化合物晶体类型为
(5)可以验证④⑤两元素金属性强弱实验是
A.将在空气中放置已久的④和⑤的单质分别与热水反应
B.将除去氧化物薄膜的④与⑤的单质分别和热水作用,并滴人酚酞溶液
C.将除去氧化物薄膜的④与⑤的单质分别和2mL 1mol?L-1的盐酸反应
D.比较④与⑤两种元素的最高价氧化物的水化物的溶解性.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置知①为O、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Ar、⑨为K.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,单质越活泼;
(2)O、F元素没有最高价含氧酸,在其它元素中,非金属性越强,最高价氧化物的水化物中酸性越强;
上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成;
(3)氢氧化铝是两性氢氧化物;氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水;
(4)元素①与⑥形成的化合物为SiO2,属于原子晶体,元素③与⑦形成的化合物为Na2S,属于离子化合物;
(5)可以根据金属与水反应难易程度、与酸反应剧烈程度、最高价氧化物对应水化物的碱性强弱判断,氢氧化物的溶解性为物理性质,不能比较金属性强弱.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,单质越活泼;
(2)O、F元素没有最高价含氧酸,在其它元素中,非金属性越强,最高价氧化物的水化物中酸性越强;
上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成;
(3)氢氧化铝是两性氢氧化物;氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水;
(4)元素①与⑥形成的化合物为SiO2,属于原子晶体,元素③与⑦形成的化合物为Na2S,属于离子化合物;
(5)可以根据金属与水反应难易程度、与酸反应剧烈程度、最高价氧化物对应水化物的碱性强弱判断,氢氧化物的溶解性为物理性质,不能比较金属性强弱.
解答:
解:由元素在周期表中位置知①为O、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Ar、⑨为K.
(1)稀有气体Ar,原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属单质中F2的化学性质最活泼,故答案为:Ar;F2;
(2)O、F元素没有最高价含氧酸,除O、F外,上述元素中S元素的非金属性最强,故H2SO4酸性最强,上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成,其电子式为: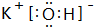 ,
,
故答案为:H2SO4;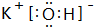 ;
;
(3)Al元素的氢氧化物--氢氧化铝,是两性氢氧化物;氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(4)元素①与⑥形成的化合物为SiO2,属于原子晶体,元素③与⑦形成的化合物为Na2S,属于离子化合物,故答案为:原子;共价;
(5)A.将在空气中放置已久的④和⑤的单质表明有氧化物膜,阻止金属单质与水的反应,故A错误;
B.根据两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,看溶液红色的深浅来确定碱性强弱,进而确定元素的金属性强弱,故B正确;
C.根据两种元素的单质粉末分别和同浓度的盐酸反应置换出氢气的难易来确定金属性强弱,故C正确;
D.氢氧化物的溶解性为物理性质,不能比较金属性强弱,故D错误,
故答案为:BC.
(1)稀有气体Ar,原子最外层为稳定结构,化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属单质中F2的化学性质最活泼,故答案为:Ar;F2;
(2)O、F元素没有最高价含氧酸,除O、F外,上述元素中S元素的非金属性最强,故H2SO4酸性最强,上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成,其电子式为:
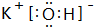 ,
,故答案为:H2SO4;
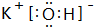 ;
;(3)Al元素的氢氧化物--氢氧化铝,是两性氢氧化物;氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(4)元素①与⑥形成的化合物为SiO2,属于原子晶体,元素③与⑦形成的化合物为Na2S,属于离子化合物,故答案为:原子;共价;
(5)A.将在空气中放置已久的④和⑤的单质表明有氧化物膜,阻止金属单质与水的反应,故A错误;
B.根据两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,看溶液红色的深浅来确定碱性强弱,进而确定元素的金属性强弱,故B正确;
C.根据两种元素的单质粉末分别和同浓度的盐酸反应置换出氢气的难易来确定金属性强弱,故C正确;
D.氢氧化物的溶解性为物理性质,不能比较金属性强弱,故D错误,
故答案为:BC.
点评:本题考查元素周期表与元素周期律的综合应用,难度不大,注意掌握金属性、非金属性强弱比较及实验事实.

练习册系列答案
相关题目
下列分散系能产生丁达尔效应的是( )
| A、食盐水 |
| B、酒精溶液 |
| C、稀硫酸 |
| D、Fe(OH)3胶体 |
试管内壁附着的下列物质不能用稀盐酸浸泡而除去的是( )
| A、长期盛放石灰水后留下的白色固体 |
| B、用一氧化碳还原氧化铁留下的黑色物质 |
| C、氯化铁溶液与氢氧化钠溶液反应留下的红褐色固体 |
| D、用适量炭粉还原氧化铜留下的红色物质 |

