题目内容
6.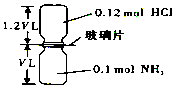 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42g | |
| C. | 生成物的分子数目为0.1NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
分析 氨气与HCl反应方程式为:HCl+NH3=NH4Cl,二者反应生成0.1mol氯化铵固体,剩余0.02molHCl,
A.容器的容积固定,反应后瓶内压强与气体的物质的量成正比;
B.根据m=nM计算出装置中H元素的总质量;
C.反应后生成0.1mol氯化铵;
D.依据瓶内外压强差解答.
解答 解:氨气与HCl反应方程式为:HCl+NH3=NH4Cl,二者反应生成0.1mol氯化铵固体,剩余0.02molHCl,
A.反应前两瓶内压强相同,反应后两瓶内压强仍然相同,反应后两瓶内压强为反应前的:$\frac{0.2mol}{0.12mol+0.1mol}$=$\frac{1}{11}$,故A错误;
B.根据质量守恒可知,装置中含有H原子的总物质的量为:0.12mol+0.1mol×3=0.42mol,质量为:1g/mol×0.42mol=0.42g,故B正确;
C.反应后生成0.1mol氯化铵,氯化铵为离子化合物,不存在氯化铵分子,故C错误;
D.反应后瓶内压强小于外界大气压,所以反应结束后,两个集气瓶不容易分开,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗应用及计算,题目难度中等,明确物质的性质及发生反应,熟悉阿伏伽德罗定律是解题关键,试题培养了学生的分析、理解能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
12.下列有关实验的说法正确的是( )
| A. | 将SO2通入溴水中,溴水褪色证明SO2具有漂白性 | |
| B. | 将含有少量HCl的Cl2通入水中以除去HCl杂质 | |
| C. | 将乙烯通入酸性KMnO4溶液中,溶液褪色证明乙烯具有还原性 | |
| D. | 将蔗糖溶液和少量稀H2SO4混合加热后,加入新制的Cu(OH)2检验蔗糖是否水解 |
10.下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是( )
| 选项 | a | b | c |  |
| A | Al | Al2O3 | Al (OH)3 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | Na[Al(OH)4] | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
15.NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA | |
| B. | 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA | |
| C. | 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同 | |
| D. | 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为NA |
16.某有机高分子化合物的结构简式如图所示.该有机高分子化合物的单体不能发生的反应是( )

| A. | 酯化反应 | B. | 氧化反应 | C. | 加成反应 | D. | 水解反应 |
 $\stackrel{P_{2}O_{5}}{→}$
$\stackrel{P_{2}O_{5}}{→}$ .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$ 
 根据如图回答:
根据如图回答: