题目内容
接触法制硫酸排放的尾气中,含少量的二氧化硫.
(1)为了测定尾气中二氧化硫的体积分数,取10.0L尾气(标准状况)缓慢通过足量的溴水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥后称重为0.233g.则尾气中二氧化硫的体积分数为 .
(2)某研究小组用氨水吸收尾气中的SO2,再向吸收液中加入硫酸,制取高浓度的SO2气及(NH4)2SO4和NH4HSO4固体.为测定所得固体样品中(NH4)2SO4和NH4HSO4的含量,现称取该样品四份,分别和80.0mL相同浓度的NaOH溶液混合,并加热到90℃左右,充分反应,使氨气全部逸出[设此时(NH4)2SO4和NH4HSO4均没发生自身的分解].测得有关实验数据如下表(气体体积均已折算为标准状况):
据此,请回答:(写出计算过程)
①当用7.4g该样品和80.0mL相同浓度的氢氧化钠溶液混合而进行同样的实验时,在标准状况下生成氨气的体积为 .
②试计算该样品中(NH4)2SO4和NH4HSO4的物质的量之比 .
③欲计算实验所用的氢氧化钠溶液的物质的量浓度,则应选择序号 的实验数据,由此求得氢氧化钠溶液的物质的量浓度为 .
(3)将尾气通入含有a mol NaOH的溶液中,充分反应,对此请画出n(Na2SO3)、n(NaHSO3)随尾气中n(SO2)的变化曲线.
(1)为了测定尾气中二氧化硫的体积分数,取10.0L尾气(标准状况)缓慢通过足量的溴水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥后称重为0.233g.则尾气中二氧化硫的体积分数为
(2)某研究小组用氨水吸收尾气中的SO2,再向吸收液中加入硫酸,制取高浓度的SO2气及(NH4)2SO4和NH4HSO4固体.为测定所得固体样品中(NH4)2SO4和NH4HSO4的含量,现称取该样品四份,分别和80.0mL相同浓度的NaOH溶液混合,并加热到90℃左右,充分反应,使氨气全部逸出[设此时(NH4)2SO4和NH4HSO4均没发生自身的分解].测得有关实验数据如下表(气体体积均已折算为标准状况):
| 实验序号 | 样品质量/g | 氢氧化钠溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 14.8 | 80.0 | 3.36 |
| Ⅱ | 29.6 | 80.0 | 4.48 |
| Ⅲ | 44.4 | 80.0 | 2.24 |
| Ⅳ | 74.0 | 80.0 | 0.00 |
①当用7.4g该样品和80.0mL相同浓度的氢氧化钠溶液混合而进行同样的实验时,在标准状况下生成氨气的体积为
②试计算该样品中(NH4)2SO4和NH4HSO4的物质的量之比
③欲计算实验所用的氢氧化钠溶液的物质的量浓度,则应选择序号
(3)将尾气通入含有a mol NaOH的溶液中,充分反应,对此请画出n(Na2SO3)、n(NaHSO3)随尾气中n(SO2)的变化曲线.
考点:二氧化硫的污染及治理,化学方程式的有关计算
专题:氧族元素
分析:(1)利用关系式:SO2~SO42-~BaSO4,根据BaSO4沉淀的质量求出SO2的体积,最后求出体积分数;
(2)①由数据Ⅰ和Ⅱ,
=
可知:当样品质量≤29.6 g时,NaOH足量,即样品质量与氨气体积比为定值;
②由H++OH-=H2O、NH4++OH-=NH3↑+H2O分析可知,样品和氢氧化钠反应的数据分析可知Ⅰ、Ⅱ实验中氢氧化钠过量,根据H++OH-=H2O,NH4++OH-=NH3↑+H2O结合质量守恒和氮元素守恒,计算硫酸铵和硫酸氢铵物质的量得到(NH4)2SO4和NH4HSO4固体混合物的组成比;
③依据Ⅲ、Ⅳ实验分析可知氢氧化钠不足,可以利用(NH4)2SO4和NH4HSO4固体混合物的组成比计算得到消耗氢氧化钠物质的量计算得到浓度;
(3)依据反应SO2+2NaOH=Na2SO3+H2O,SO2+NaOH=NaHSO3,定量关系分析,当n(SO2):n(NaOH)=1:2生成亚硫酸钠,n(SO2):n(NaOH)=1:1反应生成亚硫酸氢钠,据此解答.
(2)①由数据Ⅰ和Ⅱ,
| 14.8g |
| 3.36L |
| 29.6g |
| 4.48L |
②由H++OH-=H2O、NH4++OH-=NH3↑+H2O分析可知,样品和氢氧化钠反应的数据分析可知Ⅰ、Ⅱ实验中氢氧化钠过量,根据H++OH-=H2O,NH4++OH-=NH3↑+H2O结合质量守恒和氮元素守恒,计算硫酸铵和硫酸氢铵物质的量得到(NH4)2SO4和NH4HSO4固体混合物的组成比;
③依据Ⅲ、Ⅳ实验分析可知氢氧化钠不足,可以利用(NH4)2SO4和NH4HSO4固体混合物的组成比计算得到消耗氢氧化钠物质的量计算得到浓度;
(3)依据反应SO2+2NaOH=Na2SO3+H2O,SO2+NaOH=NaHSO3,定量关系分析,当n(SO2):n(NaOH)=1:2生成亚硫酸钠,n(SO2):n(NaOH)=1:1反应生成亚硫酸氢钠,据此解答.
解答:
解:(1)Br2具有氧化性,能氧化SO2生成SO42-,自身被还原成Br-,离子方程式为:Br2+SO2+H2O=4H++2Br-+SO42-,所以通入足量溴水的目的是Br2将SO2氧化生成SO42-,BaCl2溶液能与SO42-生成沉淀,离子方程式为:Ba2++SO42-=BaSO4↓,所以加入过量的BaCl2溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥后称重为0.233g为BaSO4,利用关系式:SO2 ~SO42-~BaSO4,
0.001mol
=1×10-3mol
n(SO2)=n(BaSO4)=1×10-3mol
10L尾气中SO2的体积为22.4L/mol×0.001mol=0.0224L,SO2的体积分数为
×100%=0.224%,
故答案为:0.224%;
(2)①V由H++OH-=H2O、NH4++OH-=NH3↑+H2O分析可知,样品和氢氧化钠反应的数据分析可知Ⅰ、Ⅱ实验中氢氧化钠过量,且
=
可知:当样品质量≤29.6 g时,样品质量与氨气体积比为定值,所以:
=
,V(NH3)=1.68 L,
故答案为:1.68L;
②设14.8g混合物中(NH4)2SO4和NH4HSO4物质的量分别为x、y,由数据Ⅰ组NaOH过量,由H++OH-=H2O、NH4++OH-=NH3↑+H2O,得:132x+115y=14.8g(质量守恒),2x+y=
(氮元素守恒)联立解这个方程组得:x=0.025mol, y=0.1mol,
=
,
故答案为:1:4;
③因
<
可知:当样品质量>44.4 g时,NaOH不足,所以选择Ⅲ或Ⅳ的实验数据计算,44.4g样品中含NH4HSO4物质的量为:44.4g×
=0.3mol,
根据发生反应的先后顺序:H++OH-=H2O、NH4++OH-=NH3↑+H2O,求得n(NaOH)=0.3mol+
=0.4mol,c(NaOH)=
=
=5mol/L,
故答案为:Ⅲ或Ⅳ;5mol/L;
(3)SO2+2NaOH=Na2SO3+H2O,SO2+H2O+Na2SO3=2NaHSO3,横坐标a点是生成亚硫酸氢钠最大时物质的量,横坐标
a点是亚硫酸钠部分反应生成亚硫酸氢钠,n(Na2SO3)、n(NaHSO3)随尾气中n(SO2)的变化曲线如图: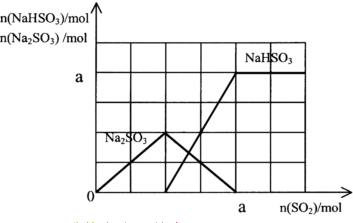 ,
,
故答案为: .
.
0.001mol
| 0.233g |
| 233g/mol |
n(SO2)=n(BaSO4)=1×10-3mol
10L尾气中SO2的体积为22.4L/mol×0.001mol=0.0224L,SO2的体积分数为
| 0.0224L |
| 10L |
故答案为:0.224%;
(2)①V由H++OH-=H2O、NH4++OH-=NH3↑+H2O分析可知,样品和氢氧化钠反应的数据分析可知Ⅰ、Ⅱ实验中氢氧化钠过量,且
| 14.8g |
| 3.36L |
| 29.6g |
| 4.48L |
| 14.8g |
| 3.36L |
| 7.4g |
| V(NH3) |
故答案为:1.68L;
②设14.8g混合物中(NH4)2SO4和NH4HSO4物质的量分别为x、y,由数据Ⅰ组NaOH过量,由H++OH-=H2O、NH4++OH-=NH3↑+H2O,得:132x+115y=14.8g(质量守恒),2x+y=
| 3.36mL |
| 22.4L/mol |
| x |
| y |
| 1 |
| 4 |
故答案为:1:4;
③因
| 14.8g |
| 3.36L |
| 44.4g |
| 2.24L |
| 0.1mol |
| 14.8g |
根据发生反应的先后顺序:H++OH-=H2O、NH4++OH-=NH3↑+H2O,求得n(NaOH)=0.3mol+
| 2.24L |
| 22.4L/mol |
| n |
| v |
| 0.4mol |
| 0.08L |
故答案为:Ⅲ或Ⅳ;5mol/L;
(3)SO2+2NaOH=Na2SO3+H2O,SO2+H2O+Na2SO3=2NaHSO3,横坐标a点是生成亚硫酸氢钠最大时物质的量,横坐标
| 1 |
| 2 |
 ,
,故答案为:
 .
.
点评:本题考查了物质组成的计算分析,画图象等知识和能力,审清题意,依据根据发生反应的先后顺序:H++OH-=H2O、NH4++OH-=NH3↑+H2O进行有关计算是关键,题目难度较大.

练习册系列答案
相关题目
实验时碰倒酒精灯,洒出的酒精在桌上燃烧起来,这时最简单的最好的扑灭方法是( )
| A、泡沫灭火剂 | B、用书本扑打 |
| C、用水冲 | D、用湿抹布扑灭 |
下列药品属于国际奥委会严格禁止的兴奋剂是( )
| A、阿司匹林 | B、青霉素 |
| C、麻黄碱 | D、氢氧化铝 |
下列关于SO2的说法正确的是( )
| A、因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 |
| B、在BaCl2溶液中通入SO2气体,溶液仍澄清,通入NO2气体有白色沉淀生成 |
| C、SO2、漂白粉都能使红墨水褪色,其原理相同 |
| D、二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性 |
在下列反应中,氧化产物与还原产物为同一物质的是( )
| A、Cl2+2NaOH═NaCl+NaClO+H2O | ||||
B、MnO2+4HCl(浓)
| ||||
| C、Fe+2HCl═FeCl2+H2↑ | ||||
| D、KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |