题目内容
1.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
分析 A.若a+b=c,改变的条件可能为增大压强;
B.若b=1,a为正整数,则增大压强,平衡正向移动;
C.由图可知,反应从正向开始,T2为平衡状态,升高温度,B的含量增大;
D.降温,正反应速率大于逆反应速率,正反应为放热反应;加压,正反应速率大于你反应速率,则A、B是气体、C、D有一种为固体或液体符合平衡正向移动.
解答 解:A.若a+b=c,改变的条件可能为增大压强,则不一定为催化剂,故A错误;
B.若b=1,a为正整数,则增大压强,平衡正向移动,G的体积分数减小,则P1<P2,故B正确;
C.由图可知,反应从正向开始,T2为平衡状态,升高温度,B的含量增大,平衡逆向移动,则正反应为放热反应,故C错误;
D.降温,正反应速率大于逆反应速率,正反应为放热反应;加压,正反应速率大于你反应速率,则A、B是气体、C、D有一种为固体或液体符合平衡正向移动.故D错误.
故选B.
点评 本题考查化学平衡与图象,明确坐标及图象中的点、线、面,明确影响反应速率及化学平衡的因素是解答的关键,侧重学生分析图象解决问题的能力的考查,题目难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
9.下列两种粒子的半径大小排列正确的是( )
| A. | Na>O | B. | Na+>O2- | C. | Mg>Na | D. | ?Μγ2+>Na+ |
6.在相同温度下,甲、乙两种溶液,甲溶液的pH是乙溶液的2倍,则甲溶液中c(H+)甲与乙溶液中c(H+)乙之比是( )
| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
1.乙苯是一种用途广泛的有机原料,可制备多种化工产品.
(一)制备苯乙烯(原理如反应I所示):
Ⅰ、 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1
(1)部分化学键的键能如下表所示:
根据反应I的能量变化,计算x=612.
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学一平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ、 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯或Cl2、α-氯乙基苯或HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HCl表示的该反应速率v(HCl)=0.032mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HC1的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
(一)制备苯乙烯(原理如反应I所示):
Ⅰ、
 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1(1)部分化学键的键能如下表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学一平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ、
 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯或Cl2、α-氯乙基苯或HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HCl表示的该反应速率v(HCl)=0.032mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HC1的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
19.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A. |  从KI和I2的固体混合物中回收I2 | |
| B. |  除去乙醇中的苯酚 | |
| C. |  实验用CCl4提取溴水中的Br2 | |
| D. |  配制100mL 0.1000mol•L-1 K2Cr2O7溶液 |
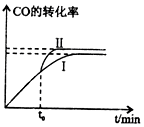 为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.