题目内容
W、X、Y、Z是短周期主族元素,它们的核电荷数依次增大.下表列出它们的性质和结构:
(1)W和X按1:1形成的化合物的电子式为 ,晶体Z属于 晶体.
(2)Y元素的单质在W和X按2:1形成的化合物中反应的离子方程式为 .
(3)Z和CO2在一定条件下反应的化学方程式为 .
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数等于s能级上的电子总数 |
(2)Y元素的单质在W和X按2:1形成的化合物中反应的离子方程式为
(3)Z和CO2在一定条件下反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是短周期元素,它们的核电荷数依次增大,X原子核外L层上s能级的电子总数为p能级上的电子总数的一半,则X为氧元素,W原子电子层数与核外电子数相等,则W为氢元素,Y元素的原子半径在短周期中最大(除稀有气体外),则Y为钠元素,原子核外p能级上的电子总数等于s能级上的电子总数,则Z为镁元素,据此答题;
解答:
解:W、X、Y、Z是短周期元素,它们的核电荷数依次增大,X原子核外L层上s能级的电子总数为p能级上的电子总数的一半,则X为氧元素,W原子电子层数与核外电子数相等,则W为氢元素,Y元素的原子半径在短周期中最大(除稀有气体外),则Y为钠元素,原子核外p能级上的电子总数等于s能级上的电子总数,则Z为镁元素,
(1)W和X按1:1形成的化合物为双氧水,它的电子式为 ,晶体镁属于金属晶体,
,晶体镁属于金属晶体,
故答案为: ;金属;
;金属;
(2)钠和水反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)镁在CO2在中能燃烧,反应的化学方程式为2Mg+CO2
2MgO+C,
故答案为:2Mg+CO2
2MgO+C;
(1)W和X按1:1形成的化合物为双氧水,它的电子式为
 ,晶体镁属于金属晶体,
,晶体镁属于金属晶体,故答案为:
 ;金属;
;金属;(2)钠和水反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)镁在CO2在中能燃烧,反应的化学方程式为2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
点评:本题主要考查了电子式和化学方程式,难度不大,解题的关键在于元素推断,解题时注意熟记常见元素化合物的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
通过置换反应不可能生成( )
| A、A12O3 |
| B、O2 |
| C、F2 |
| D、C |
1mol O2在放电条件下发生下列反应:3O2
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
| ||
| A、17.8 | B、16 |
| C、18.4 | D、35.6 |
下列离子方程式,书写正确的是( )
| A、硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ |
| B、氯化铁溶液中加入过量氨水 Fe3++3OH-=Fe(OH)3↓ |
| C、铝粉投入到NaOH溶液中 2Al+2OH-═2AlO2-+H2↑ |
| D、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
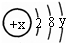 试回答:
试回答: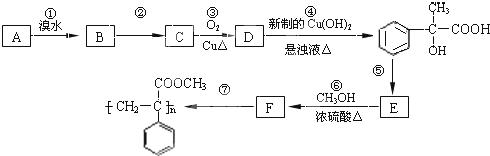
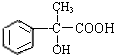 的分子式
的分子式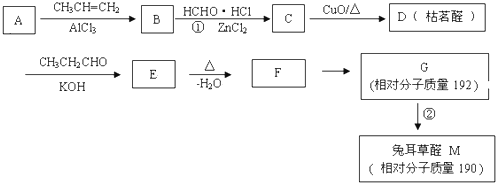
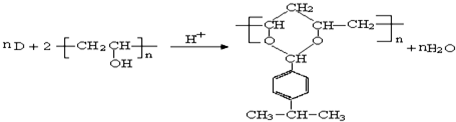
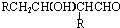
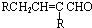
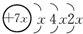 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: