题目内容
NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞.若再将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞.则下面说法正确的是( )(已知C-C键的键长1.54×10-10m)

| A、一个金刚石的晶胞中有8个C原子 |
| B、金刚石的密度为3.54g?cm-1 |
| C、在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D、在该种CO2晶胞中含氧原子8个 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、利用均摊法计算,每个金刚石晶胞占有碳原子数为:
×8+
×6+4=8;
B、根据ρ=
计算;
C、根据将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞,则该晶胞为原子晶体,不存在CO2分子;
D、根据CO2的组成,碳原子与氧原子个数比为:1:2,由A得含碳原子8个,则晶胞中含氧原子为16个.
| 1 |
| 8 |
| 1 |
| 2 |
B、根据ρ=
| m |
| V |
C、根据将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞,则该晶胞为原子晶体,不存在CO2分子;
D、根据CO2的组成,碳原子与氧原子个数比为:1:2,由A得含碳原子8个,则晶胞中含氧原子为16个.
解答:
解:A、金刚石晶胞中碳原子占据立方体的面心和顶点,晶胞内部有4个碳原子,则每个金刚石晶胞占有碳原子数为
×8+
×6+4=8,故A正确;
B、C-C键的键长1.54×10-10m,则设晶胞的边长为a,所以根据晶胞有
a=1.54×10-10m,a=2.18×10-10m,又一个一个金刚石的晶胞中有8个C原子,所以密度ρ=
=
=1.54×107g/m3,故B错误;
C、根据将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞,则该晶胞为原子晶体,不存在CO2分子,故C错误;
D、根据CO2的组成,碳原子与氧原子个数比为1:2,由A得含碳原子8个,则晶胞中含氧原子为16个,故D错误;
故选:A.
| 1 |
| 8 |
| 1 |
| 2 |
B、C-C键的键长1.54×10-10m,则设晶胞的边长为a,所以根据晶胞有
| ||
| 2 |
| m |
| V |
| ||
| (2.18×10 -10) 3 |
C、根据将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞,则该晶胞为原子晶体,不存在CO2分子,故C错误;
D、根据CO2的组成,碳原子与氧原子个数比为1:2,由A得含碳原子8个,则晶胞中含氧原子为16个,故D错误;
故选:A.
点评:本题考查了晶胞的结构,侧重于考查晶胞结构的分析和计算,注意利用均摊法计算晶胞中各种原子个数,题目难度大,解题关键是仔细观察晶胞结构图.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
2008年我国成功举办了奥运会、残奥会,让全世界人们重新认识了中国.北京奥运会期间各种污染物浓度日平均值比去年同期下降50%左右,达到世界发达城市水平,全面兑现了奥运会空气质量承诺,实现了“两个奥运,同样精彩”的目标.我国为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不利于“蓝天工程”建设的是( )
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、研制开发燃料电池汽车,消除机动车尾气污染 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |

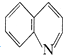 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: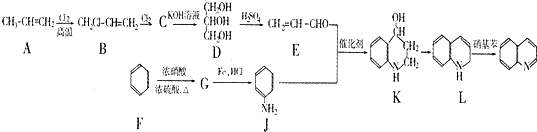
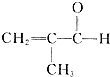 制备物质K的同系物:
制备物质K的同系物:

