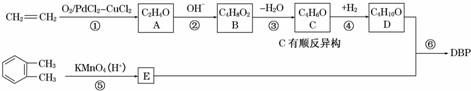
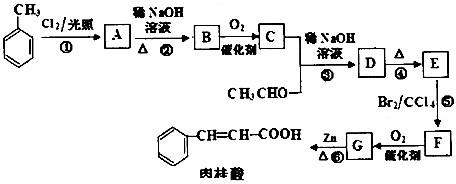
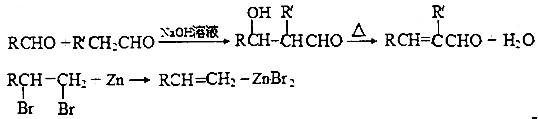题目内容
1mol C4H10(g)与不足量的氧气共贮于一固定容器中,压强为p,点火燃烧后,回到室温,得到水若干(其体积可不计)和CO2和CO两种气体,总压强降为0.557p,试问:
(1)生成的水的质量;
(2)反应前氧气的物质的量;
(3)反应后气体中CO2和CO的物质的量.
(1)生成的水的质量;
(2)反应前氧气的物质的量;
(3)反应后气体中CO2和CO的物质的量.
考点:化学方程式的有关计算
专题:烃及其衍生物的燃烧规律
分析:(1)丁烷燃烧无论生成CO还是二氧化碳都同时生成水,根据H原子守恒得n(H2O)=2n(C4H10)=2×1mol=2mol,m(H2O)=nM;
(2)相同温度下,气体的物质的量之比等于其压强之比,反应前后混合气体物质的量之比=p:0.557p=1000:557,设消耗氧气的物质的量根据压强进行计算;
(3)燃烧方程式有两个:C4H10+6.5O2=4CO2+5H2O①、C4H10+4.5O2=4CO+5H2O②,设生成CO2的丁烷为amol,则生成CO的丁烷为(1-a)mol,燃烧后减少的气体的物质的量是:1+6.18-4=3.28mol,根据气体减少的物质的量计算生成二氧化碳消耗的丁烷,再根据C原子守恒计算生成二氧化碳、CO的物质的量.
(2)相同温度下,气体的物质的量之比等于其压强之比,反应前后混合气体物质的量之比=p:0.557p=1000:557,设消耗氧气的物质的量根据压强进行计算;
(3)燃烧方程式有两个:C4H10+6.5O2=4CO2+5H2O①、C4H10+4.5O2=4CO+5H2O②,设生成CO2的丁烷为amol,则生成CO的丁烷为(1-a)mol,燃烧后减少的气体的物质的量是:1+6.18-4=3.28mol,根据气体减少的物质的量计算生成二氧化碳消耗的丁烷,再根据C原子守恒计算生成二氧化碳、CO的物质的量.
解答:
解:(1)丁烷燃烧无论生成CO还是二氧化碳都同时生成水,根据H原子守恒得n(H2O)=2n(C4H10)=2×1mol=2mol,m(H2O)=nM=2mol×18g/mol=36g,
答:生成水的质量是36g;
(2)相同温度下,气体的物质的量之比等于其压强之比,设反应耗氧的物质的量为y,则p后:p前=0.557,根据C原子守恒知生成CO和二氧化碳的物质的量之和为4mol,则0.557p:p=4mol:(1+y)mol,
y=6.18mol,
答:消耗氧气的物质的量为6.18mol;
(3)燃烧方程式有两个:C4H10+6.5O2=4CO2+5H2O①
C4H10+4.5O2=4CO+5H2O②,
设生成CO2的丁烷为amol,则生成CO的丁烷为(1-a)mol,
燃烧后减少的气体的物质的量是:1mol+6.18mol-4mol=3.28mol,
它应由两个方程式提供:
①式由1+6.5--4 减少3.5mol
②式由1+4.5--4 减少 1.5mol
所以得3.5a+1.5(1-a)=3.18
解得a=0.84mol
生成CO2的物质的量=4×0.84mol=3.36 mol,CO:4×(1-0.84)mol=0.64 mol,
答:生成二氧化碳的物质的量为3.36mol、CO的物质的量为0.64mol.
答:生成水的质量是36g;
(2)相同温度下,气体的物质的量之比等于其压强之比,设反应耗氧的物质的量为y,则p后:p前=0.557,根据C原子守恒知生成CO和二氧化碳的物质的量之和为4mol,则0.557p:p=4mol:(1+y)mol,
y=6.18mol,
答:消耗氧气的物质的量为6.18mol;
(3)燃烧方程式有两个:C4H10+6.5O2=4CO2+5H2O①
C4H10+4.5O2=4CO+5H2O②,
设生成CO2的丁烷为amol,则生成CO的丁烷为(1-a)mol,
燃烧后减少的气体的物质的量是:1mol+6.18mol-4mol=3.28mol,
它应由两个方程式提供:
①式由1+6.5--4 减少3.5mol
②式由1+4.5--4 减少 1.5mol
所以得3.5a+1.5(1-a)=3.18
解得a=0.84mol
生成CO2的物质的量=4×0.84mol=3.36 mol,CO:4×(1-0.84)mol=0.64 mol,
答:生成二氧化碳的物质的量为3.36mol、CO的物质的量为0.64mol.
点评:本题考查化学方程式的计算,明确反应前后气体的物质的量与压强关系是解本题关键,注意结合原子守恒解答,能化繁为简,提高效率,题目难度中等.

练习册系列答案
相关题目
NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞.若再将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞.则下面说法正确的是( )(已知C-C键的键长1.54×10-10m)

| A、一个金刚石的晶胞中有8个C原子 |
| B、金刚石的密度为3.54g?cm-1 |
| C、在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D、在该种CO2晶胞中含氧原子8个 |
已知BaCO3和BaSO4溶度积常数分别为KSP=5.1×10-4,KSP=1.1×10-10,则BaSO4可作钡餐,BaCO3不可作钡餐的主要理由是( )
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、SO42-没有毒性CO32-有毒性 |
| C、BaSO4密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大,造成中毒 |