题目内容
2.某种粒子有1个原子核,核中有8个质子,10个中子,核外有10个电子,该粒子的化学符号(包含质子数、质量数)是188O.分析 根据质子数确定原子序数,根据质子数与电子数的关系确定是否带电荷及电荷的多少、电性,根据质子数、中子数确定质量数.
解答 解:根据题意结合核内质子数=该元素的原子序数,确定该元素是氧元素,核内质子数比核外电子数少2,质量数=质子数+中子数=8+10=18,所以该微粒是带2个单位负电荷的质量数为18的阴离子,为188O,故答案为:188O.
点评 本题考查原子符号的书写,难度不大,解题的关键是掌握并灵活运用原子中核电荷数=核内质子数=核外电子数、相对原子质量=质子数+中子数.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
12.下列叙述不正确的是( )
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
13.有下列八种晶体:①晶体硅 ②汞 ③氯化钾 ④二氧化硅 ⑤晶体碘 ⑥溴化钠 ⑦镁 ⑧二氧化碳.
其中属于金属晶体的是②⑦(填序号,下同)
属于原子晶体的是①④
属于离子晶体的是③⑥
属于分子晶体的是⑤⑧.
其中属于金属晶体的是②⑦(填序号,下同)
属于原子晶体的是①④
属于离子晶体的是③⑥
属于分子晶体的是⑤⑧.
10.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
7.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
14. 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能与溴水发生取代反应;⑦能与碳酸钠溶液反应;⑧1mol该有机物可与2mol的钠完全反应,生成1mol氢气.
 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能与溴水发生取代反应;⑦能与碳酸钠溶液反应;⑧1mol该有机物可与2mol的钠完全反应,生成1mol氢气.
| A. | ①④ | B. | ②⑤ | C. | ②⑥ | D. | 只有⑥ |
12. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )| A. | H2O的分解反应是吸热反应 | |
| B. | 过程①是太阳能转换成化学能 | |
| C. | 过程②是化学能转换为电能 | |
| D. | 氢气不易贮存和运输,无开发利用价值 |
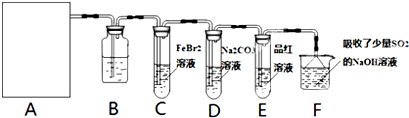
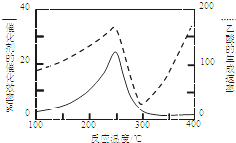 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.