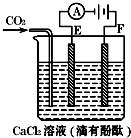
题目内容
将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为( )
| A、0.5mol/L |
| B、1.0mol/L |
| C、1.5mo l/L |
D、2.0 mo l/L |
考点:有关混合物反应的计算
专题:计算题
分析:反应生成硫酸铝、硫酸镁,硫酸可能有剩余,向反应后的混合溶液中加入NaOH溶液,恰好使Al3+、Mg2+完全沉淀,此时溶液中溶质为Na2SO4,根据钠离子守恒有n(NaOH)=2n(Na2SO4),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),据此计算n(NaOH),再根据c=
计算.
| n |
| V |
解答:
解:反应生成硫酸铝、硫酸镁,硫酸可能有剩余,向反应后的混合溶液中加入100 mL NaOH溶液,恰好Al3+、Mg2+刚好全部转化为沉淀,此时溶液中溶质为Na2SO4,
根据硫酸根守恒,有n(Na2SO4)=n(H2SO4)=0.1L×0.5mol/L=0.05mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol,则该c(NaOH)=
=0.1mol/L,故选B.
根据硫酸根守恒,有n(Na2SO4)=n(H2SO4)=0.1L×0.5mol/L=0.05mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol,则该c(NaOH)=
| 0.01mol |
| 0.1L |
点评:本题考查了混合物的计算,明确最后溶液中的溶质是解本题关键,本题采取守恒法解答,如果考虑每一步反应较麻烦且易出现错误,同时考查学生分析问题及解决问题的能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA代表阿伏加德罗常数,下列有关叙述错误的是( )
| A、向FeI2溶液中通入足量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目3NA | ||
| B、1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 | ||
| C、在反应KIO3+6HI=3I2+KI+3H2O中,每生成1mol I2转移电子数为2NA | ||
D、CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为
|
石油气中主要成份是烷烃.某石油气充分燃烧后,在相同条件下测得生成的二氧化碳的体积是该石油气体积的1.5倍,则石油气中一定有( )
| A、甲烷 | B、乙烷 | C、丁烷 | D、戊烷 |
某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理不正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
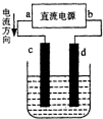 如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、c为阳极、d为阴极 |
| C、c的电极反应式:2H++2e→H2↑ |
| D、电解过程中,d极的质量增加 |
铝的活泼性较强,直到18世纪人类才开始将Al从它的化合物中冶炼出来.当时铝价格十分昂贵,拿破仑的头盔就是用Al制作的,现在还保存在英国博物馆中.电解熔融的氧化铝(冰晶石作助熔剂)时,当电路中通过10mol电子时,理论上析出铝的质量是( )
| A、90g | B、180g |
| C、270g | D、540g |
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,下列推测正确的是 ( )
| Q | R | ||
| T | W |
| A、Q形成的化合物的种类最多 |
| B、T位于元素周期表的第三周期第III族 |
| C、Q和R的气态氢化物,前者比后者稳定 |
| D、原子及简单离子半径均是T>W |