题目内容
如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2连续通入电解液中.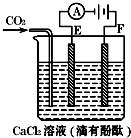
(1)电解时,F极发生 反应,电极反应式为 ,E极发生 反应,电极反应式为 ,电解总反应的离子方程式为 .
(2)电解池中产生的现象:① ;② ;③ .

(1)电解时,F极发生
(2)电解池中产生的现象:①
考点:电解原理
专题:电化学专题
分析:(1)在电解池中,和电源的正极相连的是阴极,该极上是电解质中的阳离子发生的得电子的还原反应,和电源正极相连的是阳极,该极上是电解质中的阴离子发生失电子的演化反应,据此来回答;
(2)根据电解池中的两极反应结合产物来确定现象.
(2)根据电解池中的两极反应结合产物来确定现象.
解答:
解:(1)电解时,F极和电源的正极相连,作阳极,发生氧化反应:2Cl--2e-═Cl2↑,E极和电源的负极相连,是阴极,发生还原反应,该极上的电极反应为:2H++2e-=H2↑,为还原反应,电解的总化学方程式为CaCl2+2H2O
Ca(OH)2+Cl2↑+H2↑,即2Cl-+2H2O
2OH-+H2↑+Cl2↑;
故答案为:氧化;2Cl--2e-═Cl2↑;还原;2H++2e-═H2↑;2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)在该电解池中,阴极上的电极反应为:2H++2e-=H2↑,所以该极显示碱性,遇到酚酞使得溶液显示红色,即E电极附近产生出气泡,溶液显示红色,反应有氢氧化钙生成,所以通入二氧化碳会出现白色沉淀碳酸钙生成,
故答案为:①E电极附近产生出气泡;②E电极附近溶液显示红色;③溶液中先出现白色沉淀,继续通CO2沉淀又消失.
| ||
| ||
故答案为:氧化;2Cl--2e-═Cl2↑;还原;2H++2e-═H2↑;2Cl-+2H2O
| ||
(2)在该电解池中,阴极上的电极反应为:2H++2e-=H2↑,所以该极显示碱性,遇到酚酞使得溶液显示红色,即E电极附近产生出气泡,溶液显示红色,反应有氢氧化钙生成,所以通入二氧化碳会出现白色沉淀碳酸钙生成,
故答案为:①E电极附近产生出气泡;②E电极附近溶液显示红色;③溶液中先出现白色沉淀,继续通CO2沉淀又消失.
点评:本题涉及电解池的工作原理等知识,注意电极反应式的书写是关键,难度不大.

练习册系列答案
相关题目
LiAIH4的结构式为 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )| A、释放出H2的厦应都是放热反应 |
| B、LiAIH4中含有离子键、共价键 |
| C、LiAIH4与乙醛作用生成乙醇,LiAIH4作氧化剂 |
| D、LiAIH4在125℃分解,每转移2mol电子放出2.24L的H2 |
Mg、Al 两者组成的混合物与足量盐酸反应,产生 H2在标准状况下的体积是4.48L,下列推断中不正确的是( )
| A、参加反应的Mg、Al 两者共0.2 mol. |
| B、参加反应的HCl 共0.4 mol. |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量稀硫酸反应产生H20.2 mol |
将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为( )
| A、0.5mol/L |
| B、1.0mol/L |
| C、1.5mo l/L |
D、2.0 mo l/L |
用惰性电极电解AgNO3溶液,在阳极上收集到0.28L气体(标准状况下),用NaOH溶液中和电解生成的酸需要250mL,则NaOH溶液的物质的量浓度为( )
| A、0.05mol?L-1 |
| B、0.10mol?L-1 |
| C、0.15mol?L-1 |
| D、0.20mol?L-1 |
碳电极电解R(NO3)x水溶液,在阴极析出金属R的质量为m克,阳极放出标况下560ml氧气.则该金属原子量为( )
| A、11.2mX | ||
B、
| ||
| C、10mx | ||
D、
|




 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2. 实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是( )
实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是( )