题目内容
NA代表阿伏加德罗常数,下列有关叙述错误的是( )
| A、向FeI2溶液中通入足量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目3NA | ||
| B、1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 | ||
| C、在反应KIO3+6HI=3I2+KI+3H2O中,每生成1mol I2转移电子数为2NA | ||
D、CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为
|
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、向FeI2溶液中通入足量氯气,I->Fe2+,当有1mol Fe2+被氧化时碘离子全部被氧化;
B、1 mol Mg全部反应,依据镁的原子结构分析计算电子转移;
C、反应中碘元素化合价+5价变化为0价,-1价变化为0价,电子转移数为5;
D、CO2通过足量Na2O2使固体增重56g,电子转移2mol,增重bg时,电子转移
;
B、1 mol Mg全部反应,依据镁的原子结构分析计算电子转移;
C、反应中碘元素化合价+5价变化为0价,-1价变化为0价,电子转移数为5;
D、CO2通过足量Na2O2使固体增重56g,电子转移2mol,增重bg时,电子转移
| bNA |
| 28 |
解答:
解:A、向FeI2溶液中通入足量氯气,I->Fe2+,当有1mol Fe2+被氧化时,2mol碘离子全部被氧化,电子转移数目3NA,故A正确;
B、1 mol Mg全部反应,依据镁的原子结构分析计算电子转移,与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子,故B正确;
C、反应中碘元素化合价+5价变化为0价,-1价变化为0价,生成3molI2电子转移数为5,每生成1mol I2转移电子数为
NA,故C错误;
D、2CO2+2Na2O2=2Na2CO3+O2,CO2通过足量Na2O2使固体增重56g时电子转移2mol,增重bg时,电子转移
,故D正确;
故选C.
B、1 mol Mg全部反应,依据镁的原子结构分析计算电子转移,与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子,故B正确;
C、反应中碘元素化合价+5价变化为0价,-1价变化为0价,生成3molI2电子转移数为5,每生成1mol I2转移电子数为
| 5 |
| 3 |
D、2CO2+2Na2O2=2Na2CO3+O2,CO2通过足量Na2O2使固体增重56g时电子转移2mol,增重bg时,电子转移
| bNA |
| 28 |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应顺序进行,电子转移计算分析掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
关于原子核外电子排布不正确的是( )
| A、表示一个原子在第三能层上有10个电子应该写成3s23p63d2 |
| B、电子排布1s22s22p7违背了泡利原理 |
| C、基态铁原子的外围电子排布式为4s2 |
| D、基态Si原子的电子排布式为1s22s22p63s23p2 |
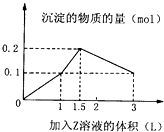 某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )| A、硫酸铝、硫酸铁、氢氧化钠 |
| B、硫酸铝、硫酸镁、氢氧化钠 |
| C、偏铝酸钠、氢氧化钡、硫酸 |
| D、偏铝酸钠、氯化钡、硫酸 |
LiAIH4的结构式为 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )| A、释放出H2的厦应都是放热反应 |
| B、LiAIH4中含有离子键、共价键 |
| C、LiAIH4与乙醛作用生成乙醇,LiAIH4作氧化剂 |
| D、LiAIH4在125℃分解,每转移2mol电子放出2.24L的H2 |
木炭、铁粉、二氧化锰、氧化铜、氧化亚铁均为黑色粉末,若只用一种试剂鉴别,应选择下列中的( )
| A、稀硫酸 | B、稀盐酸 |
| C、稀硝酸 | D、浓盐酸 |
下列物质可用溴水鉴别的是( )
| A、汽油、四氯化碳和水 |
| B、氯化钠、溴化钠、碘化钾 |
| C、硝酸银、氢氧化钠和碘化钠 |
| D、HCl、HBr、HI |
将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为( )
| A、0.5mol/L |
| B、1.0mol/L |
| C、1.5mo l/L |
D、2.0 mo l/L |
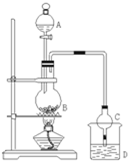 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.