题目内容
19.X、Y、Z均为短周期元素,原子序数依次增大,X3+比Z2-少一个电子层.以下说法不正确的是( )| A. | 原子半径:X>Y>Z | B. | 氧化物的熔点:Z>X | ||
| C. | 简单氢化物稳定性:Z>Y | D. | X、Y、Z单质的晶体类型可能有三种 |
分析 X、Y、Z均为短周期元素,原子序数依次增大,X3+比Z2-少一个电子层,则X3+含有2个电子层,Z2-含有3个电子层,所以X为第三周期元素,即X为Al元素,Z为第三周期元素,最外层电子数为6,所以Z为S元素,Y的原子序数介于Al、S之间,可能是Si或P,结合元素化合物的性质和元素周期律解答.
解答 解:X、Y、Z均为短周期元素,原子序数依次增大,X3+比Z2-少一个电子层,则X3+含有2个电子层,Z2-含有3个电子层,所以X为第三周期元素,即X为Al元素,Z为第三周期元素,最外层电子数为6,所以Z为S元素,Y的原子序数介于Al、S之间,可能是Si或P,
A.同周期从左到右随着原子序数增大,原子半径减小,则原子半径:X>Y>Z,故A正确;
B.Al的氧化物为离子晶体,S的氧化物为分子晶体,则氧化物的熔点:X>Z,故B错误;
C.同周期从左到右随着原子序数增大,非金属性逐渐增强,其氢化物稳定性增强,所以简单氢化物稳定性:Z>Y,故C正确;
D.若X、Y、Z分别为Al、Si、S,则其单质分别为金属晶体、原子晶体、分子晶体,故D正确.
故选B.
点评 本题考查原子结构和元素周期律,明确元素周期律内涵是解本题关键,熟练掌握元素周期律并灵活运用,注意把握非金属性与其气态氢化物的稳定性关系,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
9.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
10.下列叙述和离子方程式都正确的是( )
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
14.某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质.
(1)提出问题:Fe3+、Br2,谁的氧化性更强.
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2 (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+ 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+ (填离子的化学式).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
(1)提出问题:Fe3+、Br2,谁的氧化性更强.
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2 (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+ 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+ (填离子的化学式).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
4.我国南朝(梁)陶弘景著《本草经集注》中记叙药物730种,其中“消石”条目下写道:“…如握雪不冰.强烧之,紫青烟起,仍成灰…”.这里的“消石”是指( )
| A. | 氯化钠 | B. | 硝酸按 | C. | 高锰酸钾 | D. | 硝酸钾 |
11.a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.a、d的简单离子的电子层结构相同,b、c原子的次外层电子数均为8.下列说法正确的是( )
| A. | 氢化物的沸点:c>d | |
| B. | a、b、d的最高价氧化物对应的水化物两两皆能反应 | |
| C. | a、b、c的简单离子都会破坏水的电离平衡 | |
| D. | 简单离子的半径:c>d>a>b |
8.化学在环境保护中起着十分重要的作用,电化学降解MO3-的原理如图所示:则下列判断正确的是
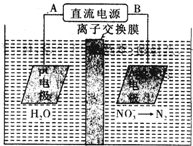

| A. | 电源正极为B | |
| B. | 若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(|△m左|-|△m右|)为7.2克 | |
| C. | Pt电极上产物为H2 | |
| D. | Ag-Pt电极上发生氧化反应 |
9.W、X、Y、Z是1-20号元素中的四种元素,原子序数依次增大;W的主要化合价为-2价,原子半径为0.074nm,X所在的主族序数与所在的周期序数之差为3;Y原子最外层电子数为奇数;Z最高价氧化物对应的水化物电离出的阴、阳离子数目相等,下列说法正确的是( )
| A. | W可能是氧元素,也可能是硫元素 | |
| B. | X元素氧化物对应的水化物一定是一种强酸 | |
| C. | Y元素原子次外层电子数与最外层电子敦之差为1 | |
| D. | Z可能是氯元素,也可能是钾元素 |