题目内容
9.下列实验操作能达到预期实验目的是( )| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属的表面积应该相同,不能用镁条和铝粉分别与盐酸反应;
B.加入的氯化镁溶液应该过量,才能证明氢氧化镁沉淀转化成了氢氧化铁;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物氧化性;
D.配制1.0mol/L的氢氧化钠溶液时,应该用100mL容量瓶配制,不能直接用100mL蒸馏水溶解.
解答 解:A.验证Mg和Al的金属性强弱时,金属的表面积应该相同,都是Mg条和Al条或镁粉和铝粉,否则接触面积影响反应速率,干扰的检验结果,无法达到预期的实验目的,故A错误;
B.向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,氯化镁溶液不足,则反应后氢氧化钠有剩余,再加入3滴1mol/L FeCl3溶液,过量的氢氧化钠会与铁离子反应生成氢氧化铁,无法证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,所以应该加入过量的氯化镁溶液,该实验无法达到预期的实验目的,故B错误;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物氧化性,该反应中氯化铁是氧化剂、碘是氧化产物,则氧化性氧化性:Fe3+>I2,该实验能够达到预期的实验目的,故C正确;
D.配制1.0mol/L的NaOH溶液,应该选用100mL的容量瓶配制,若将4g(0.1mol)氢氧化钠晶体溶于100mL蒸馏水中,所得溶液体积不是0.1L,所得溶液浓度也不是1.0mol/L,该操作方法无法达到预期的实验目的,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度中等,涉及金属性强弱判断、难溶物溶解平衡及转化、溶于配制、还原性强弱比较等知识,明确实验原理是解本题关键,注意氧化性、金属性强弱的判断方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
19.以惰性电极电解AgNO3溶液.若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Ag的质量为( )
| A. | 1.08 g | B. | 1.28 g | C. | 2.16 g | D. | 4.32 g |
20.下列关于物质分类的说法正确的是( )
| A. | CO2、NO2均为酸性氧化物 | B. | 石英、水玻璃均为纯净物 | ||
| C. | NaCl、BaSO4均为强电解质 | D. | 烧碱、纯碱均为碱 |
17.常温下,向等物质的量浓度的两种一元酸的钠盐溶液中,分别通入少量的二氧化碳气体,发生如下反应:NaA+CO2+H2O═NaHCO3+HA;2NaB+CO2+H2O═Na2CO3+2HB;则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是( )
| A. | HA较强 | B. | HB较强 | C. | 两者一样 | D. | 无法比较 |
4.下列离子方程式书写正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
14.同周期的A、B、D三种元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3DO4,则下列判断错误的是( )
| A. | 气态氢化物稳定性HA>H2B>DH3 | B. | 原子半径A>B>D | ||
| C. | 非金属性A>B>D | D. | 阴离子还原性B2->A- |
1.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
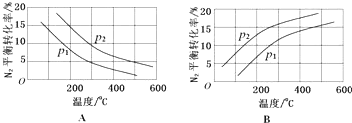
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
18.下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
19.X、Y、Z均为短周期元素,原子序数依次增大,X3+比Z2-少一个电子层.以下说法不正确的是( )
| A. | 原子半径:X>Y>Z | B. | 氧化物的熔点:Z>X | ||
| C. | 简单氢化物稳定性:Z>Y | D. | X、Y、Z单质的晶体类型可能有三种 |