题目内容
9.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多 | |
| C. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+135.9 kJ•mol-1 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.设二者质量都是1g,然后根据题干热化学方程式计算;
C.酸碱中和反应生成的硫酸钡过程放热,则其焓变不是-57.3 kJ•mol-1;
D.①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1,按盖斯定律计算①×3-②得到:6H2(g)+2CO2(g)═2CH3OH(l)+2H2O(l),据此进行计算.
解答 解:A.根据2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知1mol氢气燃烧生成1mol液态水放出热量为285.8 kJ•mol-1,则氢气燃烧热为285.8 kJ•mol-1,故A错误;
B.同质量的H2(g)和CH3OH(l)完全燃烧,设质量为1g
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2 571.6kJ
$\frac{1}{2}$mol 142.9kJ
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
2 1452kJ
$\frac{1}{32}$mol 22.69kJ
所以H2(g)放出的热量多,故B正确;
C.反应中有BaSO4(s)生成,而生成BaSO4也是放热的,所以放出的热量比57.3 kJ多,即该反应的△H<-57.3 kJ•mol-1,故C错误;
D.①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
按盖斯定律计算①×3-②得到:6H2(g)+2CO2(g)═2CH3OH(l)+2H2O(l)△H=-262.8 kJ•mol-1,则正确的热化学方程式是:3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-131.4 kJ•mol-1,故D错误;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度中等,涉及燃烧热,中和热、盖斯定律等知识,明确盖斯定律的内容及应用方法为解答关键,试题培养了学生的灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2 | B. | CO | C. | CH3COOH | D. | C12H22O11 |
| A. | 常温下,向100gNaOH饱和溶液中加入0.39gNa2O2固体,恢复到常温,NaOH溶液的物质的量浓度一定不变 | |
| B. | 向一恒容容器中充入lmolN2和lmolH2,在一定条件下反应并达到平衡.升温,再次达到平衡状态,N2的体积分数一定不变 | |
| C. | 向50mL0.55mol/L的NaOH溶液中加入50mL0.50mol/L的稀盐酸,测定中和热,继续加入6mL等浓度的稀盐酸,测定的中和热一定不变 | |
| D. | 将2.3gNa投入100mL水中,产生H2,若在反应前向水中加入100 mL煤油,则产生H2的速率一定不变 |
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
| A. | 404 | B. | 72 | C. | 230 | D. | 200 |
| 选项 | 现象或事实 | 解 释 |
| A | 用含有铁粉的透气小袋与食品一起密封包装 | 利用铁粉的吸水性 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是两性氧化物,能溶于氢氟酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | “忽闻海上有仙山,山在虚无缥缈间”描述了海市蜃楼现象 | 是一种自然现象,与胶体知识有关 |
| A. | A | B. | B | C. | C | D. | D |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.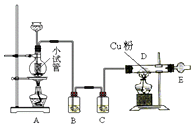 如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题:
如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题: 如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:
如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层: