题目内容
7.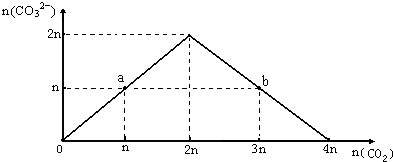 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )| A. | a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 | |
| B. | a溶液中水的电离程度与b溶液中水的电离程度相同 | |
| C. | a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
分析 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系如图,开始反应为CO2+2OH-=CO32-+H2O,碳酸根离子物质的量增大,当全部生成碳酸根离子后继续通入二氧化碳气体,发生反应CO2+CO32-+H2O=2HCO3-,a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,
A.a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,氢氧化钠和碳酸氢钠消耗盐酸量相同;
B.b点碳酸氢钠、碳酸钠水解促进水的电离,a点氢氧化钠抑制水的电离,碳酸钠促进水的电离;
C.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
D.a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,混合得到溶液为碳酸钠溶液,溶液中存在质子守恒.
解答 解:向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系如图,开始反应为CO2+2OH-=CO32-+H2O,碳酸根离子物质的量增大,当全部生成碳酸根离子后继续通入二氧化碳气体,发生反应CO2+CO32-+H2O=2HCO3-,a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,
A.a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,氢氧化钠和碳酸氢钠消耗盐酸量相同,a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同,故A正确;
B.b点碳酸氢钠、碳酸钠水解促进水的电离,a点氢氧化钠抑制水的电离,碳酸钠促进水的电离,所以b点水的电离程度大,故B错误;
C.溶液中存在电荷守恒,阴阳离子所带电荷总数相同,溶液中电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D.a点为等浓度的NaOH和Na2CO3,b点为等浓度的Na2CO3和NaHCO3,混合得到溶液为碳酸钠溶液,溶液中存在质子守恒,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选B.
点评 本题考查了电解质溶液中盐类水解原理、电荷守恒、物料守恒、质子守恒等离子浓度关系的分析判断,主要是反应过程中生成产物的分析,图象变化特征是解题关键,题目难度中等.

| A. | 室温下,12gC60和C70的混合物中含有的碳原子数为NA | |
| B. | 22.4L SO2气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 标准状况下,5.6LCCl4含有的分子数为0.25NA |
①增加C的物质的量 ②保持容器容积不变,充入N2使体系压强增大 ③将容器的容积缩小一半 ④保持压强不变,充入N2使容器容积变大.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0064mol/(L•s) | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入4molPCl3、4molCl2,达到平衡时,则此反应的化学平衡常数为0.025mol/L | |
| D. | 相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |

| A. | 水 | B. | 酒精 | C. | 稀硫酸 | D. | 植物油 |
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
时间/min n(CH4)/mol 温度 | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | 10 min内,T1时的化学反应速率比T2时大 | |
| B. | 温度:T1<T2 | |
| C. | Q>0 | |
| D. | 化学平衡常数:K(T1)<K(T2) |
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:
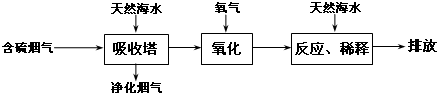
①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.