题目内容
碘化钠是实验室中常见分析试剂,常用于医疗和照相业.工业上用铁屑还原法来制备,工艺流程如下:

(1)碘元素属于第 周期第 族;反应②中的氧化剂是(写化学式) .
(2)判断反应①中的碘是否已完全转化的具体操作方法是 .
(3)反应②的离子方程式为 ;反应③的化学方程式为 .
(4)将滤液浓缩、冷却、分离、干燥和包装过程中,都需要注意的问题是 ;特别是在浓缩、冷却时最好采取的措施是 .

(1)碘元素属于第
(2)判断反应①中的碘是否已完全转化的具体操作方法是
(3)反应②的离子方程式为
(4)将滤液浓缩、冷却、分离、干燥和包装过程中,都需要注意的问题是
考点:制备实验方案的设计
专题:实验设计题
分析:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,经过滤后得到固体氢氧化铁,过滤后溶液中主要含NaI,分离、提纯得到NaI,以此来解答.
解答:
解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,经过滤后得到固体氢氧化铁,过滤后溶液中主要含NaI,分离、提纯得到NaI,
(1)碘位于周期表第五周期第ⅦA族,反应②涉及反应为2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,其中I元素化合价由+5价降低到-1价,被还原,NaIO3为氧化剂,
故答案为:五;ⅦA; NaIO3;
(2)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应①中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应混合液于试管中并滴入几滴淀粉溶液,若溶液未变蓝色,证明碘已完全转化;如果溶液变蓝,则说明碘没有转化完全;
(3)反应②涉及反应为2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,离子方程式为3Fe+IO3-+3H2O═3Fe(OH)2↓+I-,Fe(OH)2不稳定,可与空气中氧气反应而被氧化而生成Fe(OH)3,在灼烧时生成Fe2O3,则反应的总方程式为4Fe(OH)2+O2
2 Fe2O3+4H2O,
故答案为:3Fe+IO3-+3H2O═3Fe(OH)2↓+I-;4Fe(OH)2+O2
2 Fe2O3+4H2O;
(4)NaI不稳定,易被氧化而变质,在加热浓缩溶液时应充入氮气,以隔绝空气而防止被氧气氧化,
故答案为:防止NaI被空气氧化; 低压蒸发浓缩,并充入氮气隔绝空气.
(1)碘位于周期表第五周期第ⅦA族,反应②涉及反应为2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,其中I元素化合价由+5价降低到-1价,被还原,NaIO3为氧化剂,
故答案为:五;ⅦA; NaIO3;
(2)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应①中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应混合液于试管中并滴入几滴淀粉溶液,若溶液未变蓝色,证明碘已完全转化;如果溶液变蓝,则说明碘没有转化完全;
(3)反应②涉及反应为2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,离子方程式为3Fe+IO3-+3H2O═3Fe(OH)2↓+I-,Fe(OH)2不稳定,可与空气中氧气反应而被氧化而生成Fe(OH)3,在灼烧时生成Fe2O3,则反应的总方程式为4Fe(OH)2+O2
| ||
故答案为:3Fe+IO3-+3H2O═3Fe(OH)2↓+I-;4Fe(OH)2+O2
| ||
(4)NaI不稳定,易被氧化而变质,在加热浓缩溶液时应充入氮气,以隔绝空气而防止被氧气氧化,
故答案为:防止NaI被空气氧化; 低压蒸发浓缩,并充入氮气隔绝空气.
点评:本题考查物质制备实验,注意把握制备流程中发生的反应及操作,题目涉及氧化还原反应及碘的特性,注重基础知识的考查,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
已知:H2(g)+
O2(g)=H2O(l);△H=-285.83kJ?mol-1.2CO(g)+O2(g)=2CO2(g);△H=-565.8kJ?mol-1.若氢气与一氧化碳混合气体完全燃烧可生成5.4g液态水,并放出114.03kJ的热量,则混合气体中CO的物质的量是( )
| 1 |
| 2 |
| A、0.22mol |
| B、0.15mol |
| C、0.1mol |
| D、0.05mol |
制备Fe(OH)3胶体的方法是,向沸水中加入饱和FeCl3,然后继续加热.检验是否已经得到胶体的最简单有效的方法是( )
| A、观察颜色和状态 |
| B、观察是否能产生丁达尔现象(效应) |
| C、加入足量的盐酸 |
| D、滴入氢氧化钠溶液 |
 往100mLNaOH溶液中通入CO2,充分反应后,在减压和较低温度下,小心将溶液蒸干,得白色固体M.通入标况下CO2的体积V(CO2)(单位:mL)与M的质量(w)(单位:g)的关系如图:
往100mLNaOH溶液中通入CO2,充分反应后,在减压和较低温度下,小心将溶液蒸干,得白色固体M.通入标况下CO2的体积V(CO2)(单位:mL)与M的质量(w)(单位:g)的关系如图: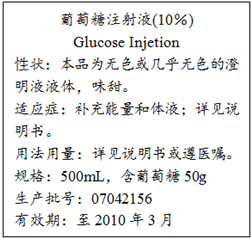 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数): 2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示:
2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示: