题目内容
配平下列方程式,并用单线桥标出反应中电子转移的方向和数目
H2O2+ H2CrO4= Cr(OH)3+ O2+ H2O.
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:该反应H2O2中O元素化合价由-1价变为0价、H2CrO4中Cr元素化合价由+6价变为+3价,转移电子总数为6,根据转移电子相等、原子守恒配平方程式.
解答:
解:该反应H2O2中O元素化合价由-1价变为0价、H2CrO4中Cr元素化合价由+6价变为+3价,转移电子总数为6,根据转移电子相等知,H2O2的计量数是3、H2CrO4的计量数是2,再结合原子守恒配平方程式为
3H2O2+2H2CrO4=2Cr(OH)3+3O2↑+2H2O,电子由双氧水转移到H2CrO4,其转移电子方向和数目为 ,故答案为:3;2;2;3;2;
,故答案为:3;2;2;3;2; .
.
3H2O2+2H2CrO4=2Cr(OH)3+3O2↑+2H2O,电子由双氧水转移到H2CrO4,其转移电子方向和数目为
 ,故答案为:3;2;2;3;2;
,故答案为:3;2;2;3;2; .
.
点评:本题考查氧化还原反应方程式的配平,根据转移电子、原子守恒配平方程式即可解答,知道常见元素化合价,注意双氧水中O元素化合价,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液不一定是钠盐溶液 |
| C、向某未知溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口,无明显现象,则原溶液中没有NH4+ |
| D、某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
下列说法中正确的是( )
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形 |
| B、能层为1时,有自旋相反的两个轨道 |
| C、能层为3时,有3s、3p、3d、4f四个轨道 |
| D、s电子云是球形对称的,其疏密程度表示电子在该处出现的几率大小 |
下列说法中不正确的是( )
| A、处于最低能量的原子叫做基态原子 |
| B、4f 4表示4f能级有四个轨道 |
| C、同一原子中,2p、3d、4f能级的轨道数依次增多 |
| D、同一原子中,2p、3p、4p电子的能量逐渐增大 |
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A、若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B、若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2 |
| C、若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为:甲<丙<戊 |
| D、若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用 |
下列说法正确的是( )
A、
| ||||||
| B、强电解质中不含共价键 | ||||||
| C、25℃时,pH=9的Na2CO3溶液和pH=5的AlCl3溶液中,水的电离程度相同 | ||||||
| D、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa的c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)混合溶液: |
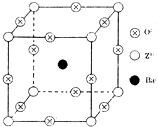 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.