题目内容
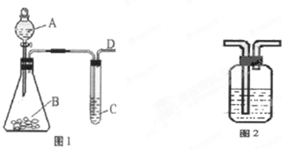 某同学用如图1所示的装置来探究SO2的性质及有关实验.
某同学用如图1所示的装置来探究SO2的性质及有关实验.(1)实验前应先检验装置的气密性,方法是
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式
(3)分别将SO2气体通入气体下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是
②SO2通入紫红色KMnO4溶液,现象是
③SO2慢慢通入澄清石灰水中,现象
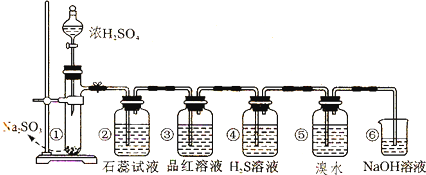
(4)若同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体.可以选择图2洗气装置设计实验.洗气装置里的溶液是:
A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液.
上述装置的所装试剂连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)
考点:探究二氧化硫与水和品红溶液的反应
专题:实验设计题
分析:(1)运用气体的体积热胀冷缩的原理检查装置的气密性;
(2)亚硫酸钠和浓硫酸反应生成硫酸钠和水和二氧化硫,据此书写化学方程式;
(3)①二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;二氧化硫不能漂白指示剂;
②二氧化硫具有还原性,和氧化剂能发生氧化还原反应,能使高锰酸钾溶液褪色;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙;
(4)设计实验证明混合气体中既有SO2气体,又有CO2气体,利用品红褪色,说明反应生成SO2,除去SO2,再用澄清石灰水检验CO2.
(2)亚硫酸钠和浓硫酸反应生成硫酸钠和水和二氧化硫,据此书写化学方程式;
(3)①二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;二氧化硫不能漂白指示剂;
②二氧化硫具有还原性,和氧化剂能发生氧化还原反应,能使高锰酸钾溶液褪色;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙;
(4)设计实验证明混合气体中既有SO2气体,又有CO2气体,利用品红褪色,说明反应生成SO2,除去SO2,再用澄清石灰水检验CO2.
解答:
解:(1)如果装置封闭,不漏气,用双手(或热毛巾)握住B时,相当于给装置中的气体加热,气体的体积热胀冷缩,C中有气泡产生,移开双手,温度降低,气体的体积缩小,C中导管形成一段水柱,
故答案为:用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气;
(2)亚硫酸钠(Na2SO3)固体与较浓硫酸(H2SO4)在锥形瓶内反应,生成硫酸钠和水和二氧化硫,化学反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.
故答案为:紫色溶液变为红色;红色不褪去;
②二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,
故答案为:紫红色褪去;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2,
故答案为:首先有白色沉淀生成,然后白色沉淀消失;
(4)二氧化硫能和氢氧化钙反应生成不溶于水的亚硫酸钙和水,溶液变浑浊,离子反应方程式为:Ca2++2OH-+SO2=CaSO3 ↓+H2O,要证明气体中既有SO2又有CO2,先把混合气体通过品红试液,褪色证明含有二氧化硫,再通过高锰酸钾溶液除去二氧化硫,通过品红试液不褪色证明二氧化硫除净,最后通过澄清石灰水变浑浊证明含有二氧化碳;或先把混合气体通过品红试液,褪色证明含有二氧化硫,再通过高锰酸钾溶液除去二氧化硫,再通过高锰酸钾溶液不褪色,证明二氧化硫除净,最后通过澄清石灰水变浑浊证明含有二氧化碳,
故答案为:D、F、D、E或D、F、F、E.
故答案为:用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气;
(2)亚硫酸钠(Na2SO3)固体与较浓硫酸(H2SO4)在锥形瓶内反应,生成硫酸钠和水和二氧化硫,化学反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.
故答案为:紫色溶液变为红色;红色不褪去;
②二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,
故答案为:紫红色褪去;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2,
故答案为:首先有白色沉淀生成,然后白色沉淀消失;
(4)二氧化硫能和氢氧化钙反应生成不溶于水的亚硫酸钙和水,溶液变浑浊,离子反应方程式为:Ca2++2OH-+SO2=CaSO3 ↓+H2O,要证明气体中既有SO2又有CO2,先把混合气体通过品红试液,褪色证明含有二氧化硫,再通过高锰酸钾溶液除去二氧化硫,通过品红试液不褪色证明二氧化硫除净,最后通过澄清石灰水变浑浊证明含有二氧化碳;或先把混合气体通过品红试液,褪色证明含有二氧化硫,再通过高锰酸钾溶液除去二氧化硫,再通过高锰酸钾溶液不褪色,证明二氧化硫除净,最后通过澄清石灰水变浑浊证明含有二氧化碳,
故答案为:D、F、D、E或D、F、F、E.
点评:本题考查学生对实验原理与装置的理解与评价、常用化学用语书写、离子具检验与实验方案设计、阅读获取信息能力等,掌握二氧化硫酸性氧化物性质、漂白性、还原性等是解题关键,题目难度中等.

练习册系列答案
相关题目
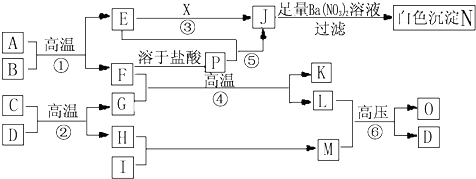
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A、若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B、若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2 |
| C、若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为:甲<丙<戊 |
| D、若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用 |
下列叙述中不正确的是( )
| A、2.0 g重水(D2O)中含有的质子数和中子数都为1.0 NA |
| B、pH>7的溶液中:Na+、K+、CO32-、ClO一、S2-不能大量共存 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、酒精溶于水时没有破坏化学键 |
下列叙述中正确的是( )
| A、金属钠、镁、铝化学性质活泼,均须密封保存 |
| B、酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
| C、可用玻璃棒蘸少量待测物质的浓溶液做焰色反应 |
| D、可用盐酸清洗长期存放三氯化铁溶液的试剂瓶 |
下列说法中不正确的是( )
| A、乙醇和乙酸都能与金属钠反应,也都能发生酯化反应 |
| B、乙烯和苯都能使酸性KMnO4褪色,也都能发生加成反应 |
| C、乙酸和油脂都能与氢氧化钠溶液反应,也都能发生氧化反应 |
| D、淀粉和蛋白质都是天然高分子化合物,也都能发生水解反应 |
 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).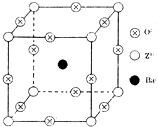 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.