题目内容
3.下列离子方程式属于水解的是( )| A. | HCO3-+H2O?H3O++CO32- | B. | ClO-+H3O+?HClO+H2O | ||
| C. | HS-+H2O?H2S+OH- | D. | NH4++OH-?NH3•H2O |
分析 水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答 解:A.HCO3-+H2O?H3O++CO32-,是碳酸氢根离子的电离方程式,不是水解离子方程式,故A错误;
B.ClO-+H3O+?HClO+H2O是次氯酸根离子与氢离子结合为酸的反应,不是水解反应,故B错误;
C.HS-+H2O?H2S+OH-,是硫氢根离子的水解离子方程式,故C正确;
D.NH4++OH-?NH3•H2O,是铵根离子和氢氧根离子发生的复分解反应,不是水解反应,故D错误;
故选C.
点评 本题考查学生对水解反应原理的理解,题目难度不大,明确水解的反应原理是解答本题的关键,注意区分反应、水解和电离,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
13. 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )| A. | 硝基胍分子中只含极性键,不含非极性键 | |
| B. | 硝基胍中有C、H、O、N四种元素,属于氨基酸 | |
| C. | 硝基胍分子中σ键与π键的个数比是5:1 | |
| D. | 10.4 g该物质含有1.1×6.02×1023个原子 |
18.反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k•Cm(H2)•Cn(Cl2),式中的k为常数,m和n的值以可用下列表中数据确定之.由此可以推得,m和n的值正确的是( )
| H2(mol/L) | Cl2(mol/L) | V(mol/L•S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=2 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=1,n=$\frac{1}{2}$ | D. | m=$\frac{1}{2}$,n=1 |
8.含硅物质在生产生活中应用广泛,下列含硅物质的用途中涉及化学性质的是( )
| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
15.对于苯乙烯( )的下列叙述,其中正确的是( )
)的下列叙述,其中正确的是( )
①能使酸性KMnO4溶液褪色 ②可发生加聚反应 ③可溶于水 ④不可溶于苯中 ⑤能与浓HNO3发生取代反应 ⑥所有的原子可能共面⑦能发生取代反应.
 )的下列叙述,其中正确的是( )
)的下列叙述,其中正确的是( )①能使酸性KMnO4溶液褪色 ②可发生加聚反应 ③可溶于水 ④不可溶于苯中 ⑤能与浓HNO3发生取代反应 ⑥所有的原子可能共面⑦能发生取代反应.
| A. | ①②④⑤ | B. | ①②⑤⑥⑦ | C. | ①②④⑤⑥ | D. | ①②③④⑤⑥⑦ |
12. 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为 .
.
②工业上可利用反应Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=+11.3 kJ/mol.
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为.
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
①甲容器中,0~40min内用NH3的浓度变化表示的平均反应速率v(NH3)=6.25×10-8mol•L-1•min-1.
②该反应的△H< 0(填“>”或“<”),理由是温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小.
③对该反应,下列说法正确的是AB (填选项字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中Cl2转化率最高的是B 点(填“A”“B”或“C”).
②计算C点时该反应的压强平衡常数Kp(C)=0.5MPa(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为
 .
.②工业上可利用反应Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=+11.3 kJ/mol.
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的△H< 0(填“>”或“<”),理由是温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小.
③对该反应,下列说法正确的是AB (填选项字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中Cl2转化率最高的是B 点(填“A”“B”或“C”).
②计算C点时该反应的压强平衡常数Kp(C)=0.5MPa(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
10.下列说法中正确的是( )
| A. | 某溶液与NaOH共热,产生能使湿润的蓝色石蕊试纸变红的气体,说明原溶液中一定存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中可能含有CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时,火焰呈黄色,说明原溶液中一定含有Na+,也可能含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中一定存在SO42- |
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
 ;
;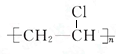 ,其反应类型为加聚反应.
,其反应类型为加聚反应.