题目内容
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]?nH2O可用于摄影和蓝色印刷.为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
【实验Ⅰ】草酸根含量的测定
称取0.9820g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358K,用0.2000mol?L-1 KMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+.达到滴定终点时,共消耗KMnO4溶液12.00ml.
【实验Ⅱ】铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失.冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00ml.(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题:
(1)实验Ⅰ在滴定过程中反应的离子方程式为 .
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低”或“不变”).
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成(写出计算过程).
【实验Ⅰ】草酸根含量的测定
称取0.9820g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358K,用0.2000mol?L-1 KMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+.达到滴定终点时,共消耗KMnO4溶液12.00ml.
【实验Ⅱ】铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失.冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00ml.(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题:
(1)实验Ⅰ在滴定过程中反应的离子方程式为
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则测定的Fe3+的含量将会
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为
(4)通过计算确定样品晶体的组成(写出计算过程).
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)实验Ⅰ在滴定过程中反应是酸性高锰酸钾溶液具有强氧化性氧化草酸为二氧化碳,本身被还原为锰离子;
(2)若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则溶液中有剩余的MnO4-,MnO4-能氧化I-生成碘单质,从而导致与碘单质反应的Na2S2O3溶液的体积增大,因此导致测定Fe3+的含量偏高;
(3)由于单质I2遇到淀粉变蓝色,所以费用终点的实验现象是滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变化为无色且半分钟不变化,证明反应达到终点;
(4)依据氧化还原反应,结合化学方程式定量关系计算得到,2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;2MnO4-~5C2O42-; 2S2O32-~I2~2 Fe3+;
(2)若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则溶液中有剩余的MnO4-,MnO4-能氧化I-生成碘单质,从而导致与碘单质反应的Na2S2O3溶液的体积增大,因此导致测定Fe3+的含量偏高;
(3)由于单质I2遇到淀粉变蓝色,所以费用终点的实验现象是滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变化为无色且半分钟不变化,证明反应达到终点;
(4)依据氧化还原反应,结合化学方程式定量关系计算得到,2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;2MnO4-~5C2O42-; 2S2O32-~I2~2 Fe3+;
解答:
解:(1)实验Ⅰ在滴定过程中反应是酸性高锰酸钾溶液具有强氧化性氧化草酸为二氧化碳,本身被还原为锰离子,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑;
(2)若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则溶液中有剩余的MnO4-,MnO4-能氧化I-生成碘单质,从而导致与碘单质反应的Na2S2O3溶液的体积增大,因此导致测定Fe3+的含量偏高;
故答案为:偏高;
(3)由于单质I2遇到淀粉变蓝色,所以费用终点的实验现象是滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变化为无色且半分钟不变化,证明反应达到终点;
故答案为:滴下最后一滴Na2S2O3标准溶液,溶液由蓝色变成无色,且半分钟内不变色;
(4)依据氧化还原反应,结合化学方程式定量关系计算得到,2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;
2MnO4-~5C2O42-;
2 5
0.2×12×10-3mol n(C2O42-)
n(C2O42-)=6×10-3mol
2S2O32-~I2~2 Fe3+;
2 2
0.25×8×10-3mol n(Fe3+)
n(Fe3+)=2×10-3mol
依据溶液中电荷守恒n(K+)=6×10-3mol
结合质量守恒得到:m(H2O)=0.9820g-39g/mol×6×10-3mol-56g/mol×2×10-3mol-88g/mol×6×10-3mol=0.108g
n(H2O)=
=6×10-3mol
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3
化学式为K3Fe(C2O4)3?3H2O
答:化学式为K3Fe(C2O4)3?3H2O.
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑;
(2)若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则溶液中有剩余的MnO4-,MnO4-能氧化I-生成碘单质,从而导致与碘单质反应的Na2S2O3溶液的体积增大,因此导致测定Fe3+的含量偏高;
故答案为:偏高;
(3)由于单质I2遇到淀粉变蓝色,所以费用终点的实验现象是滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变化为无色且半分钟不变化,证明反应达到终点;
故答案为:滴下最后一滴Na2S2O3标准溶液,溶液由蓝色变成无色,且半分钟内不变色;
(4)依据氧化还原反应,结合化学方程式定量关系计算得到,2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;
2MnO4-~5C2O42-;
2 5
0.2×12×10-3mol n(C2O42-)
n(C2O42-)=6×10-3mol
2S2O32-~I2~2 Fe3+;
2 2
0.25×8×10-3mol n(Fe3+)
n(Fe3+)=2×10-3mol
依据溶液中电荷守恒n(K+)=6×10-3mol
结合质量守恒得到:m(H2O)=0.9820g-39g/mol×6×10-3mol-56g/mol×2×10-3mol-88g/mol×6×10-3mol=0.108g
n(H2O)=
| 0.108g/mol |
| 18g/mol |
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3
化学式为K3Fe(C2O4)3?3H2O
答:化学式为K3Fe(C2O4)3?3H2O.
点评:本题考查了氧化还原反应滴定实验的分析判断和定量计算应用,主要是化学式的计算分析,实验过程的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列溶液中的离子因发生氧化-还原反应而不能大量共存的是( )
| A、Na+、Al3+、SO42-、HCO3- |
| B、K+、Fe3+、Cl-、SCN- |
| C、Ca2+、Na+、ClO-、S2- |
| D、Ca2+、Ba2+、F-、Br- |
在相同温度和相同浓度下的各种稀溶液中,下列各项排列可能不正确的是( )
| A、溶液的酸性:H2SO4>Al2(SO4)3>NH4NO3 |
| B、溶液的pH:Na2CO3>NaHCO3>CH3COONa |
| C、由水电离出的c(OH-):NaCl>HCl>NaOH |
| D、带电微粒数:Na2S>H2SO4>Mg(OH)2 |
现有如下5种无色溶液:NaAlO2、KOH、NaCl、MgCl2 稀氨水,若要将其一一鉴别开,至少需要用多少种试剂?( )
| A、不用试剂 | B、1种 |
| C、2种 | D、3种 |
下列反应处于平衡状态,2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,欲提高平衡常数K的值,应采取的措施是( )
| A、降低温度 | B、增大压力 |
| C、加入氧气 | D、去掉三氧化硫 |


 ):
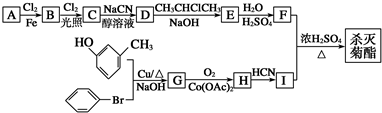
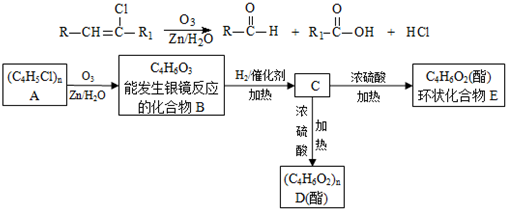
):
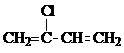 加聚而成,写出A的结构简式
加聚而成,写出A的结构简式