题目内容
X、Y、Z和W都是短周期元素,且原子半径逐渐减小,已知:
①W和Z能形成两种常见的化合物
②Z和Y能形成两种常见的气态化合物
③X的阳离子和Z的阴离子具有相同的核外电子排布,能形成组成为XZ的化合物
④Y、Z和W形成的化合物是实验室制备Y2W4的主要试剂
(1)X元素是 ;Z元素是 .
(2)W和Z形成的两种化合物的电子式分别是 和 .
(3)Y和Z形成的化合物与X单质反应的化学方程式: .
(4)写出反应④的化学方程式 .
①W和Z能形成两种常见的化合物
②Z和Y能形成两种常见的气态化合物
③X的阳离子和Z的阴离子具有相同的核外电子排布,能形成组成为XZ的化合物
④Y、Z和W形成的化合物是实验室制备Y2W4的主要试剂
(1)X元素是
(2)W和Z形成的两种化合物的电子式分别是
(3)Y和Z形成的化合物与X单质反应的化学方程式:
(4)写出反应④的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的阳离子Z的阴离子具有相同的核外电子排布,且能形成组成为XZ的化合物,XZ型的离子化合物只能是ⅠA-ⅦA与ⅡA-ⅥA,短周期元素中只可能形成MgO、NaF两种物质;
Z和Y能形成两种常见的气态化合物,结合④可知XZ只能为MgO,原子半径X>Z,则X为Mg、Z为O;Y可能为C、S元素,再根据Y能够形成化合物Y2W4可知W应该为H元素、Y为C元素,Y2W4为C2H4,据此进行解答.
Z和Y能形成两种常见的气态化合物,结合④可知XZ只能为MgO,原子半径X>Z,则X为Mg、Z为O;Y可能为C、S元素,再根据Y能够形成化合物Y2W4可知W应该为H元素、Y为C元素,Y2W4为C2H4,据此进行解答.
解答:
解:(1)X的阳离子Z的阴离子具有相同的核外电子排布,且能形成组成为XZ的化合物,XZ型的离子化合物只能是ⅠA-ⅦA与ⅡA-ⅥA,短周期元素中只可能形成MgO、NaF两种物质;
Z和Y能形成两种常见的气态化合物,结合④可知XZ只能为MgO,原子半径X>Z,则X为Mg、Z为O;Y可能为C、S元素,再结合Y能够形成化合物Y2W4可推测W应该为H元素、Y为C元素,Y2W4为C2H4,
根据分析可知:X为Mg元素、Z为O元素,
故答案为:Mg;O;
(2)W为H元素、Z为O元素,则二者形成的化合物为水和双氧水,二者都是共价化合物,其分子式分别为: 、
、 ,
,
故答案为: ;
; ;
;
(3)Y和Z形成的化合物为二氧化碳,X单质为金属镁,二者反应生成氧化镁和碳,反应的化学方程式为:CO2+2Mg
2MgO+C,
故答案为:CO2+2Mg
2MgO+C;
4)反应④为乙醇在浓硫酸作用下加热到170℃制取乙烯,反应的化学方程式为:CH3-CH2-OH
CH2=CH2↑+H2O,
故答案为:CH3-CH2-OH
CH2=CH2↑+H2O.
Z和Y能形成两种常见的气态化合物,结合④可知XZ只能为MgO,原子半径X>Z,则X为Mg、Z为O;Y可能为C、S元素,再结合Y能够形成化合物Y2W4可推测W应该为H元素、Y为C元素,Y2W4为C2H4,
根据分析可知:X为Mg元素、Z为O元素,
故答案为:Mg;O;
(2)W为H元素、Z为O元素,则二者形成的化合物为水和双氧水,二者都是共价化合物,其分子式分别为:
 、
、 ,
,故答案为:
 ;
; ;
; (3)Y和Z形成的化合物为二氧化碳,X单质为金属镁,二者反应生成氧化镁和碳,反应的化学方程式为:CO2+2Mg
| ||
故答案为:CO2+2Mg
| ||
4)反应④为乙醇在浓硫酸作用下加热到170℃制取乙烯,反应的化学方程式为:CH3-CH2-OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3-CH2-OH
| 浓硫酸 |
| 170℃ |
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素的名称为解答关键,推断过程中需要根据所学知识及化合物组成情况推测,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
某二元酸H2A在水中发生电离:H2A=H++HA-(完全电离),HA-?H++A2-.下列叙述中一定不正确的是( )
| A、在NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+) |
| B、在Na2A溶液中:c(Na+)>c(A2-)>c(OH-)>c(H+) |
| C、在NaHA溶液中:c(H+)=c(A2-)+c(OH-) |
| D、在H2A溶液中:c(H+)=c(HA-)+c(OH-)+2c(A2-) |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
| A、A=B |
| B、A=10-4 B |
| C、B=10-4 A |
| D、无法确定 |
在溶液中能与Fe3+共存的微粒是( )
| A、Cu |
| B、S2- |
| C、CO32- |
| D、Fe2+ |

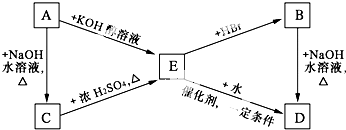
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有如图所示的转换关系,甲是工业上制取A的主要原料.请回答:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有如图所示的转换关系,甲是工业上制取A的主要原料.请回答: 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题: