题目内容
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
2FeSO4-7H2O
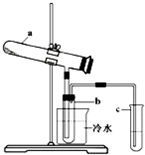
Fe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )

2FeSO4-7H2O
| ||
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42- |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |

A、若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO4,二氧化硫不能喝氯化钡反应,故A错误;
B、b中产物用紫色石蕊试液能检验出氢离子的存在,但检验不出硫酸根离子,故B错误;
C、氢氧化钠只能吸收二氧化硫无现象判断,应用品红试液检验,故C错误;
D、化学反应中生成1molSO3,14molH2O,发生SO3+H2O=H2SO4;反应后溶液中含13molH2O;1molH2SO4;溶质质量分数=
=29.5%;故D正确;
故选D.
B、b中产物用紫色石蕊试液能检验出氢离子的存在,但检验不出硫酸根离子,故B错误;
C、氢氧化钠只能吸收二氧化硫无现象判断,应用品红试液检验,故C错误;
D、化学反应中生成1molSO3,14molH2O,发生SO3+H2O=H2SO4;反应后溶液中含13molH2O;1molH2SO4;溶质质量分数=
| 1mol×98g/mol |
| 1mol×98g/mol+13mol×18g/mol |
故选D.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
 生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:

 Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
