题目内容
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
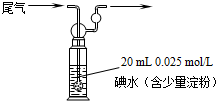
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O ![]() Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )

A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
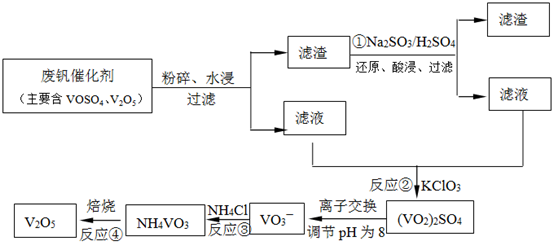
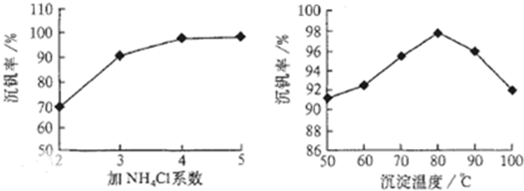
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。

(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
(1) D(2分),(2)防止催化剂中毒(2分) (3)冷凝管(1分)
(4) 2VOSO4=SO2+V2O5+SO3(2分) (5)CaSO4·2H2O(3分)
解析:
(1)将分解生成的气体通入BaCl2溶液中,生成的沉淀是BaSO4;根据绿矾分解的方程式,产物Fe2O3留在试管中,SO3和H2O同时冷凝便得到硫酸,收集在试管a中,硫酸的检验分为两部分,既要检验H+,又要检验SO42—,要回答全面。试管b中溶液用来检验SO2气体,故用品红溶液,SO2能使品红溶液退色,加热红色恢复。根据生成SO3与水的物质的量之比,可以求得生成硫酸的理论浓度:设生成1molSO3和14molH2O,硫酸的质量分数为98/(80+14×18)=29.5%。(2)由于接触室中使用V2O5作催化剂,为防止催化剂中毒,因此必须进行除杂操作。(4)根据催化剂的性质可知催化剂(V2O5)在反应过程中先参与反应,而后又生成,化学性质和质量在反应前后不变,在反应a中钒元素化合价降低被还原,可推知还原剂应为SO2,化学方程式可表示为SO2+V2O5=V2O4+SO3,反应b中根据元素守恒可确定SO2也参与反应,钒元素化合价不变,硫元素化合价升高被氧化,因此反应过程中O2也参与反应,化学方程式可表示为V2O4+2SO2+O2=2VOSO4,该反应属于化合反应,因此原子利用率为100%,反应c中有V2O5生成,可推知反应c为2VOSO4=SO2+V2O5+SO3。
(5)要考虑到SO2和碱或盐反应生成的亚硫酸盐,亚硫酸盐有较强的还原性易被空气氧化,结合产物的相对分子质量172可确定产物为生石膏CaSO4·2H2O,其中反应的化学方程式可表示为:2SO2+O2+2CaCO3+4H2O=2 [CaSO4·2H2O] +2CO2 或2SO2+O2+2Ca(OH)2+2H2O=2 [CaSO4·2H2O]


 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: