题目内容
11.CO的应用和治理问题属于当今社会的热点问题.(1)氢氰酸是很弱的一种酸,在浓度均为0.1mol•L-1HCN和NaCN混合溶液中,各种离子浓度由大到小的顺序为c(Na+)>c(CN-)>c(OH-)>c(H+),.
(2)为防止镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2.该反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.(已知:硫的燃烧热为296kJ•mol-1;一氧化碳的燃烧热为283kJ•mol-1)
(3)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)制备.图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题:

①0~10min内,反应的平均速率v(Cl2)=0.09mol•L-1•min-1.
②若保持温度不变,容器体积为2L,在第8min加入体系中的三种物质各1mol,则平衡向正反应方向移动(填“向正反应方向”“向逆反应方向”或“不”).
③随压强的增大,该反应平衡常数变化的趋势是不变(填“增大”“减小”或“不变”);还可以通过改变加入催化剂或改变反应物的浓度等条件的方法达到一样的效果.
④第10min时改变的反应条件是升高温度.
分析 (1)氢氰酸是很弱的一种酸,在浓度均为0.1 mol•L-1HCN和NaCN混合溶液中,HCN的电离程度小于NaCN的水解程度,溶液显碱性;
(2)硫的燃烧热为296 kJ•mol-1;一氧化碳的燃烧热为283 kJ•mol-1,则S(s)+O2(g)=SO2(g)△H1=-296 kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283 kJ•mol-1;
依据盖斯定律②×2-①得到所需热化学方程式;
(3)①由图可知,10min时Cl2的平衡浓度为0.3 mol•L-1,变化为1.2 mol•L-1-0.3 mol•L-1=0.9 mol•L-1,反应速率v=$\frac{△c}{△t}$计算得到;
②平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,计算浓度商和平衡常数比较平淡反应进行的方向;
③平衡常数只与温度有关,改变压强、浓度不影响平衡常数;
④根据图象,在第10分钟时反应物的浓度增大,生成物的浓度减小,平衡逆向进行;
解答 解:(1)氢氰酸是很弱的一种酸,在浓度均为0.1 mol•L-1HCN和NaCN混合溶液中,HCN的电离程度小于NaCN的水解程度,溶液显碱性,故溶液中离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(2)硫的燃烧热为296 kJ•mol-1;一氧化碳的燃烧热为283 kJ•mol-1,则S(s)+O2(g)=SO2(g)△H1=-296 kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283 kJ•mol-1;
依据盖斯定律②×2-①得到:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=2△H2-△H1=(-2×283+296)kJ•mol-1=-270 kJ•mol-1,
故答案为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-270 kJ•mol-1;
(3)①由图可知,10min时Cl2的平衡浓度为0.3 mol•L-1,变化为1.2 mol•L-1-0.3 mol•L-1=0.9 mol•L-1,则v=$\frac{0.9mol/L}{10min}$=0.09 mol•L-1•min-1,
故答案为:0.09 mol•L-1•min-1;
②8 min时,平衡时c(Cl2)=0.3 mol•L-1、c(CO)=0.1 mol•L-1、c(COCl2)=0.9 mol•L-1,
Cl2(g)+CO(g)?COCl2(g)
K=$\frac{c(COC{l}_{2})}{c(C{l}_{2})c(CO)}$=$\frac{0.9}{0.3×0.1}$=30.容器体积为2 L,在第8 min再加入体系中的三种物质各1 mol,Qc=$\frac{1.9}{1.3×1.1}$≈2.92<K,所以平衡向正反应方向移动,
故答案为:向正反应方向;
③平衡常数只与温度有关,压强增大,平衡常数不变,加入催化剂或改变浓度能改变反应速率,不改变化学平衡,
故答案为:不变;加入催化剂或改变反应物的浓度等;
④根据图象,在第10分钟时反应物的浓度增大,生成物的浓度减小,故改变的条件是升高温度,平衡逆向移动,
故答案为:升高温度.
点评 本题考查了盐类水解、弱电解质电离平衡、热化学方程式书写、平衡常数计算、影响很小平衡和平衡常数的因素等知识点,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 钢铁腐蚀时可能发生的正极反应 2H2O+O2+4e-═4OH- | |
| B. | 表示H2燃烧热的热化学方程式 2H2(g)+O2 (g)═2H2O(g);△H=-483.6kJ/mol | |
| C. | 纯碱水解的离子方程式 CO32-+H2O?HCO3-+OH- | |
| D. | Ca(HCO3)2溶液中加入过量澄清石灰水 Ca2++HCO3-+OH-═CaCO3↓+H2O |
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致,将锌块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 汽车尾气中除含有NOx,还含有PM2.5容易形成雾霾,“雾霾”的分散质微粒相同 | |
| C. | 双氧水、高锰酸钾溶液可以消灭病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
| A. | 在羽毛球、网球等体育项目中做球拍的碳纤维材料是一种新型无机非金属材料 | |
| B. | 从海水中提取溴和镁都必须通过化学反应才能实现 | |
| C. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| D. | 用饱和NH4Cl溶液可除去铁表面的锈斑 |
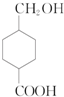 .M的同分异构体有多种,符合下列条件的同分异构体有( )
.M的同分异构体有多种,符合下列条件的同分异构体有( )①六元环上有3个取代基,②官能团不变,③两个官能团不能连接在同一个碳原子上.
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | 元素的非金属性顺序为a>b | |
| B. | a和c形成的离子化合物中可能含有共价键 | |
| C. | d的最高价氧化物对应的水化物可溶于c的最高价氧化物对应水化物的水溶液 | |
| D. | 五种元素离子半径最小的是d |
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |

 ;
; ;
;