��Ŀ����
17��NaCN����ĵ�Ʒ�ˮ����������������������1��NaCN��NaClO��Ӧ������NaOCN��NaCl
��2��NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2
��֪HCN��Ki=6.3��10-10���о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ��
���������գ�
��1����һ������ʱ����Һ��pHӦ����Ϊ���ԣ�ѡ����ԡ��������ԡ������ԡ�����ԭ���Ƿ�ֹ����HCN�������Ա�ж�����Ⱦ������
��2��д���ڶ�������ʱ������Ӧ�����ӷ���ʽ2OCN-+3ClO-=CO32-+CO2��+3Cl-+N2����
��3������100m3��NaCN 10.3mg/L�ķ�ˮ��ʵ��������NaClO14900g��ʵ������ӦΪ����ֵ��4����������ʹNaCN��������0.5mg/L���ﵽ�ŷű���
��4����CN��2��Cl2�Ļ�ѧ�������ƣ���CN��2��NaOH��Һ��Ӧ����NaOCN��NaCN��H2O��
���� ��1��NaCN�����ᷢ����Ӧ����HCN����HCN�о綾����Ӧ��ʹ��Һ��pH�ʼ��ԣ�
��2����Ӧ����Ԫ�صĻ��ϼ۴�+1�۽��͵�-1�ۣ��õ�2�����ӣ�NԪ�ػ��ϼ۴�-3�����ߵ�0�ۣ�ʧȥ3�����ӣ����������ԭ��Ӧ�л��ϼ����������ƽ��
��3���μӷ�Ӧ��NaCNΪ$\frac{100����10.3-0.5��}{49}$=20mol����Ӧ��C��+2�����ߵ�+4�ۣ�NԪ�ػ��ϼ۴�-3�����ߵ�0�ۣ���1molNaCNʧȥ5mol���ӣ�1mol�������Ƶõ�2mol���ӣ����õ����غ���㣻
��4����CN��2��Cl2�Ļ�ѧ�������ƣ���������������������Һ��Ӧ��ԭ��������CN��2��NaOH��Һ��Ӧ���
��� �⣺��1��NaCN�����ᷴӦ����HCN��Ϊ��ֹ����HCN�������Ա�ж�����Ⱦ��������˵�һ������ʱ����Һ��pHӦ����Ϊ���ԣ�
�ʴ�Ϊ�����ԣ���ֹ����HCN�������Ա�ж�����Ⱦ������
��2����Ӧ����Ԫ�صĻ��ϼ۴�+1�۽��͵�-1�ۣ��õ�2�����ӣ�NԪ�ػ��ϼ۴�-3�����ߵ�0�ۣ�ʧȥ3�����ӣ�����ݵ��ӵ�ʧ�غ��֪��ԭ���������������ʵ���֮����2��3����Ӧ�����ӷ���ʽΪ��2OCN-+3ClO-=CO32-+CO2��+3Cl-+N2����
�ʴ�Ϊ��2OCN-+3ClO-=CO32-+CO2��+3Cl-+N2����
��3���μӷ�Ӧ��NaCN�ǣ�$\frac{100����10.3-0.5��}{49}$=20mol����Ӧ��C��+2�����ߵ�+4�ۣ�NԪ�ػ��ϼ۴�-3�����ߵ�0�ۣ���1molNaCNʧȥ5mol���ӣ�1mol�������Ƶõ�2mol���ӣ����Դ���100 m3��NaCN 10.3 mg/L�ķ�ˮ��ʵ��������NaClO������Ϊ��$\frac{20mol��5}{2}$��74.5g/mol��4=14900g��
�ʴ�Ϊ��14900��
��4����CN��2��Cl2�Ļ�ѧ�������ƣ���������������������Һ��Ӧ��ԭ����֪����CN��2��NaOH��Һ��Ӧ����NaOCN��NaCN����H2O��
�ʴ�Ϊ��NaOCN��NaCN��
���� ���⿼����������ԭ��Ӧ����ʽ��д�ͼ��㣬��Ŀ�Ѷ��еȣ���ȷ������ԭ��Ӧ��ʵ�ʼ���ƽԭ��Ϊ���ؼ�������֪ʶ��϶࣬��ֿ�����ѧ���ķ������������Ӧ��������

| A�� | $\frac{49a}{b}$ mol-1 | B�� | $\frac{49b}{a}$ mol-1 | C�� | $\frac{98a}{b}$ mol-1 | D�� | $\frac{98b}{a}$ mol-1 |
��1����ˮ�ĵ��뷽��ʽΪNH3•H2O?NH4++OH-���������ˮ��Һ��ˮ������ӷ���ʽΪNH4++H2O?NH3•H2O+H+��
��2�������£���0.1000mol•L-1����ζ�0.1000mol•L-1��ˮ����ζ�������ͼ��ʾ��
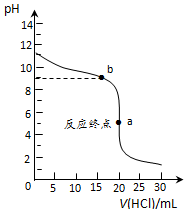
�ٸõζ����˵�ָʾ��Ϊ���ȣ�ѡ������ȡ�������̪������ʯ�����
��ͼ�С�a���㴦��Һ����������Ũ�ȴӴ�С��˳��Ϊc��Cl-����c��NH4+����c��H+����c��OH-����
����֪ͼ�С�b���㴦����Һ������4c��NH4+��=7c��NH3•H2O��������ʱKb��NH3•H2O��=1.75��10-5������ֵ����
��3��ʵ���ҳ����ü�ȩ���ⶨ�������Ʒ�е�Ԫ�ص�������������Ӧԭ��Ϊ��
4NH4++6HCHO�T4H++��CH2��6N4+6H2O�� H++OH-�TH2O
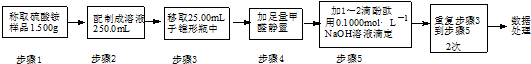
�ζ���������ʾ��
| �ζ����� | ������Һ�� ���/mL | ����Һ�����/mL | |
| �ζ�ǰ�̶� | �ζ���̶� | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
���Ԫ���غ㣬n��N��=n��NH4+��=n��NaOH��=0.1000mol•L-1��20.00mL��10-3L•mL-1=2.000��10-3mol��w��N��=$\frac{14g/mol��2.000��1{0}^{-3}mol}{1.500g��\frac{25.00mL}{250.0mL}}$��18.67%����
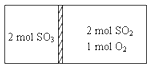 һ�������´��ڷ�Ӧ��2SO2��g��+O2��g��?2SO3��g��H=196kJ•moL�����ܱ��������м���岻�ܴ��������������ɻ���������ͼ��ʾͶ�ϣ�һ��ʱ��ﵽƽ��ʱ������˵����ȷ�ģ�������
һ�������´��ڷ�Ӧ��2SO2��g��+O2��g��?2SO3��g��H=196kJ•moL�����ܱ��������м���岻�ܴ��������������ɻ���������ͼ��ʾͶ�ϣ�һ��ʱ��ﵽƽ��ʱ������˵����ȷ�ģ�������| A�� | ���������£��ﵽƽ����������SO3�����������ͬ | |
| B�� | ���������£����������ߵ����ջ�ų���������ֵ֮��С��Ϊ196kJ | |
| C�� | ������Ϊ���ȣ��ﵽƽ��ʱ���ҷ�Ӧ���ʵ������ҷ�Ӧ���� | |
| D�� | ������Ϊ����������������SO2��ת����������SO3��ת����֮��С��1 |