题目内容
18. 用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题(1)所需仪器为:托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管,还需要哪些玻璃仪器才能完成该实验,请写出:250mL容量瓶.
(2)请写出该实验的简要的实验步骤:
①计算②称量胆矾25.0g ③溶解 ④转移⑤洗涤并转移 ⑥定容 ⑦摇匀
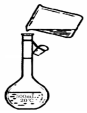
(3)如图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流.
分析 (1)溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,根据配制溶液的实验操作过程选择所需的仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)移液时应用玻璃棒引流,防止液体洒出.
解答 解:(1)实验室没有240mL容量瓶,选择250mL容量瓶.
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故还需要的玻璃仪器有:250mL容量瓶;
故答案为:250mL容量瓶;
(2)配制0.40mol/L的CuSO4溶液250mL,需要胆矾质量为:0.40mol/L×0.25L×250g/mol=25.0g;
故答案为:25.0;
(3)该同学转移溶液的示意图中未用玻璃棒引流;
故答案为:未用玻璃棒引流.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度不大,明确配制步骤为解答关键,注意掌握配制过程中误差分析的方法与技巧,试题有利于培养学生的化学实验能力.

练习册系列答案
相关题目
8.氨和铵盐既是实验室常用试剂又是重要化工原料.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.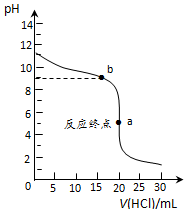
①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O
滴定结果如表所示:
试计算该样品中氮元素的质量分数(写出计算过程)计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.

①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O

滴定结果如表所示:
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
13.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 将1 mol PbS冶炼成Pb理论上至少需要6 g碳 | |
| B. | 浮选法富集方铅矿的过程属于化学变化 | |
| C. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| D. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
3.根据等电子原理判断,下列说法中正确的是( )
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
10.足量浓硫酸与mg铜反应得到标准状况下SO2nL,则被还原的酸是( )
| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |
8.实验室用98%的浓硫酸(密度为1.84g/mL)配置100mL 1mol/L的稀硫酸,已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是( )
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |